题目内容
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。
Ⅰ.利用甲醇(CH3HO)制备甲醛
脱氢法:CH3OH(g) HCHO(g)+H2 (g) ΔH1=+92.09kJ·mol -1
氧化法:CH3OH(g)+1/2O2(g)HCHO(g)+H2O(g) ΔH2
(1)脱氢法制甲醛,有利于提高平衡产率的条件有________ (写出一条)。
(2)已知:2 H2(g) + O2(g)= 2H2O(g) ΔH3=-483.64kJ·mol -1,则ΔH2=________________。
(3)750K 下,在恒容密闭容器中,充入一定量的甲醇,发生脱氢法反应,若起始压强为P0,达到平衡时转化率为40.0% ,则反应的平衡常数Kp=________(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(4)Na2CO3是脱氢法反应的催化剂,有研究指出,催化反应的部分机理如下:
历程i :CH3OH→·H+ ·CH2OH 历程ii :·CH2OH→·H+ HCHO
历程iii:.·CH2OH→3·H +CO 历程iv:·H+·H→H2
如图所示为在体积为1L的恒容容器中,投入1mol CH3OH,在碳酸钠催化剂作用下,经过10min反应,测得甲醇的转化率(X)与甲醇的选择性(S)与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比)。回答下列问题:
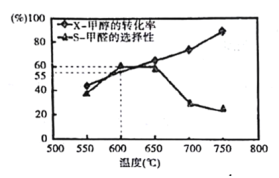
①600℃时,前10min内甲醛的平均速率为v(HCHO)=______
②从平衡角度分析550℃- 650℃甲醇生成甲醛的转化率随温度升高的原因为______;
③反应历程i的活化能______(填“>”“<” 或“=”)CH3OH(g)HCHO(g)+H2(g)活化能。
④650℃- 750℃反应历程ii的速率_______(填“>”“<” 或“=”)反应历程iii的速率。
Ⅱ.甲醛超标会危害人体健康,需对甲醛含量检测及处理。
某甲醛气体探测仪利用燃料电池工作原理,b电极反应方程式为________。

【答案】升高温度或降低压强 -149.73 kJ·mol -1 ![]() 0.033mol/(L·min) 甲醇脱氢为吸热反应,升高温度,有利于脱氢反应向正反应方向进行 < < HCHO-4e-+H2O=CO2+4H+
0.033mol/(L·min) 甲醇脱氢为吸热反应,升高温度,有利于脱氢反应向正反应方向进行 < < HCHO-4e-+H2O=CO2+4H+
【解析】
Ⅰ.(1)脱氢法制甲醛,CH3OH(g) HCHO(g)+H2 ΔH1=+92.09kJ·mol -1,由于该反应的正反应是吸热反应,所以可以升高温度,使平衡正向移动,从而提高甲醛的产率;又由于该反应的正反应是体积增大的反应,所以可以降低压强使平衡正向移动,也可以提高甲醛的产率。故答案为升高温度或降低压强。
(2)根据①CH3OH(g) HCHO(g)+H2 (g) ΔH1=+92.09kJ·mol -1和②2 H2(g) + O2(g)= 2H2O(g) ΔH3=-483.64kJ·mol -1,①+②÷2即可得到反应CH3OH(g)+1/2O2(g)HCHO(g)+H2O(g),ΔH2=+92.09kJ·mol -1+(-483.64kJ·mol -1)÷2=-149.73 kJ·mol -1。
(3)用三段式解答:起始压强为P0,达到平衡时转化率为40.0% ,则
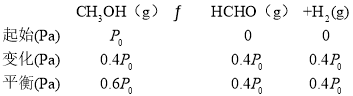
则反应的中衡常数Kp=![]() =
=![]() 。
。
(4)①600℃时,前10min内甲醇的物质的量变化为1mol×55%×60%=0.33mol,容器体积为1L,所以平均速率为v(CH3OH)=0.033mol/(L·min)。用不同物质表示的速率之比等于方程式的化学计量数之比,根据化学方程式,所以v(HCHO)=0.033mol/(L·min)。
②甲醛脱氢反应为吸热反应,在550℃- 650℃升高温度,有利于反应正向进行,所以甲醇生成甲醛的转化率随温度升高而增大。
③由盖斯定律可知,ⅰ+ⅱ+ⅳ得到目标方程式CH3OH(g) HCHO(g)+H2 (g),前两个历程化学键断裂吸收能量,历程ⅳ自由基结合放出能量,而总反应是吸热反应,因此反应历程i的活化能小于总反应的活化能。
④由图可知,在650℃- 750℃,随着温度升高,甲醇的转化率增大,但选择性却降低,说明甲醇更多的转化为CO,历程ⅲ的反应速率较大,因此反应历程ii的速率小于反应历程iii的速率。
Ⅱ.在燃料电池中,通入燃料的一极是负极,所以b为负极,甲醛在负极失去电子生成CO2,电解质溶液是酸性的,所以电极反应方程式为HCHO-4e-+H2O=CO2+4H+。

 黄冈天天练口算题卡系列答案
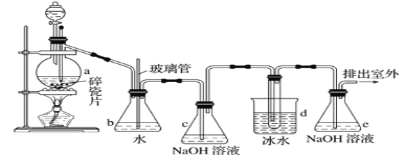
黄冈天天练口算题卡系列答案【题目】抗爆剂的添加剂常用1,2-二溴乙烷。如图为实验室制备1,2-二溴乙烷的装置图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:①_____________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是②___________________________________;
安全瓶b还可以起到的作用是③___________________________。
(2)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是_______________________。
(3)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正确情况下超过许多,如果装罝的气密性没有问题,试分析可能的原因:_____________________、_____________________________(写出两条即可)。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为________________,要进一步提纯,下列操作中必需的是
A.重结晶 B.过滤 C.萃取 D.蒸馏
(5)实验中也可以撤去d装置中盛冰水的烧杯,改为将冷水直接加入到d装置的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是___________。
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=________。