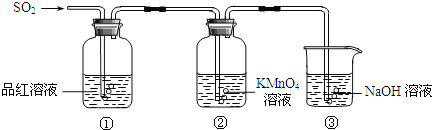
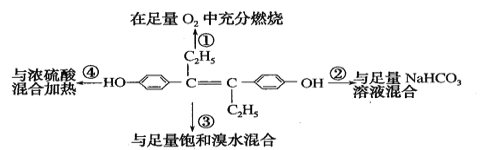
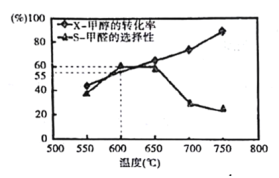
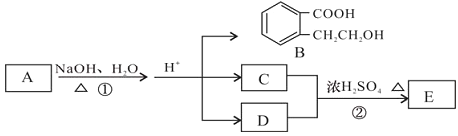
题目内容
【题目】下列离子方程式书写正确的是
A.碳酸氢钙溶液中加入过量氢氧化钠溶液:![]() +OH-=
+OH-=![]() +H2O
+H2O
B.氯化铁溶液中通入硫化氢气体:2Fe3++S2-=2Fe2++S↓
C.次氯酸钙溶液中通入少量二氧化硫:Ca2++2ClO-+H2O+SO2=CaSO3↓+2HClO
D.氯化亚铁溶液中加入硝酸:3Fe2++4H++![]() =3Fe3++2H2O+NO↑
=3Fe3++2H2O+NO↑
【答案】D
【解析】
A.碳酸氢钙溶液中加入过量氢氧化钠溶液,会生成CaCO3,离子方程式为:Ca2++2![]() +2OH-=CaCO3↓+ 2H2O+
+2OH-=CaCO3↓+ 2H2O+![]() ,A错误;
,A错误;
B.氯化铁溶液中通入硫化氢气体,H2S不能拆,离子方程式为:H2S+2Fe3+=2Fe2++S↓+2H+,B错误;
C.次氯酸钙溶液中通入少量二氧化硫,会发生氧化还原反应,离子方程式为:3ClO-+Ca2++2H2O+SO2=Cl-+CaSO4↓+2HClO,C错误;
D.氯化亚铁溶液中加入硝酸,发生氧化还原反应,离子方程式为:3Fe2++4H++![]() =3Fe3++2H2O+NO↑,D正确;
=3Fe3++2H2O+NO↑,D正确;
故选D。

练习册系列答案
相关题目
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D