题目内容
【题目】利用水钴矿(主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO、SiO2等)可以制取多种化工试剂,以下为草酸钴晶体和氯化钴晶体的制备流程,回答下列问题:
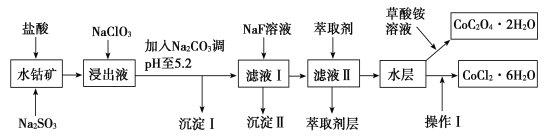
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+、Mg2+、Ca2+等。
②沉淀Ⅰ中只含有两种沉淀。
③流程中部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | 开始沉淀 | 完全沉淀 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Co(OH)2 | 7.6 | 9.2 |
Al(OH)3 | 4.0 | 5.2 |
Mn(OH)2 | 7.7 | 9.8 |
(1)浸出过程中氧化剂与还原剂物质的量之比为___。
(2)NaClO3在浸出液中发生反应的离子方程式为___。
(3)加入Na2CO3调pH至5.2,目的是___;萃取剂层含锰元素,则沉淀Ⅱ的主要成分为__。
(4)操作Ⅰ包括:将水层加入浓盐酸调整pH为2~3,___、___、过滤、洗涤、减压烘干等过程。
(5)为测定粗产品中CoCl2·6H2O的含量,称取一定质量的粗产品溶于水,加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量。通过计算发现粗产品中CoCl2·6H2O质量分数大于100%,其原因可能是___(回答一条原因即可)。
(6)将5.49g草酸钴晶体(CoC2O4·2H2O)置于空气中加热,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 150~210 | 290~320 |
固体质量/g | 4.41 | 2.41 |
经测定,整个受热过程,只产生水蒸气和CO2气体,则290~320℃温度范围,剩余的固体物质化学式为___。[已知:CoC2O4·2H2O的摩尔质量为183g·mol-1]
【答案】1:1 ![]() 使
使![]() 和
和![]() 沉淀完全 CaF2和MgF2 蒸发浓缩 冷却结晶 粗产品中结晶水含量低(或粗产品中混有氯化钠杂质) Co3O4(或 CoO·Co2O3)
沉淀完全 CaF2和MgF2 蒸发浓缩 冷却结晶 粗产品中结晶水含量低(或粗产品中混有氯化钠杂质) Co3O4(或 CoO·Co2O3)
【解析】
水钴矿中加入盐酸,可得CoCl3、FeCl3、AlCl3、MnCl2、MgCl2、CaCl2,信息①中浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等,则进入的Na2SO3将Co3+、Fe3+还原为Co2+、Fe2+,工艺流程最终得到草酸钴,加入NaClO3将Fe2+氧化为Fe3+,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MnCl2、MgCl2、CaCl2,用NaF溶液除去钙、镁,过滤后,向滤液中加入萃取剂,将锰离子萃取,萃取后的余液中主要含有CoCl2,进入草酸铵溶液得到草酸钴。
(1)浸出过程中主要发生的氧化还原反应是:![]() Co2O3是氧化剂,
Co2O3是氧化剂,![]() 是还原剂,二者的物质的量之比为1:1,故答案为:1:1
是还原剂,二者的物质的量之比为1:1,故答案为:1:1
(2)NaClO3在浸出液中是将Fe2+氧化为Fe3+,故发生反应的离子方程式为
![]() ,故答案为:
,故答案为:![]()
(3)通过信息③可知,加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,故目的是使![]() 和
和![]() 沉淀完全;萃取剂层含锰元素,说明溶液中的除锰离子和钴离子以外的金属阳离子均已除去,故加入NaF溶液是除Ca2+和Mg2+,则沉淀Ⅱ的主要成分为CaF2和MgF2,故答案为:使
沉淀完全;萃取剂层含锰元素,说明溶液中的除锰离子和钴离子以外的金属阳离子均已除去,故加入NaF溶液是除Ca2+和Mg2+,则沉淀Ⅱ的主要成分为CaF2和MgF2,故答案为:使![]() 和
和![]() 沉淀完全 CaF2和MgF2。
沉淀完全 CaF2和MgF2。
(4)从溶液中析出晶体,都要经过:蒸发浓缩、冷却结晶、过滤洗涤、干燥的过程,故答案为:蒸发浓缩 冷却结晶
(5)该步骤是通过加入足量硝酸酸化的硝酸银溶液,过滤、洗涤、干燥,测沉淀质量的方法来计算粗产品中的,粗产品中氯元素的含量偏高则结果偏高,故可能的原因有可能是结晶水不足,或者结晶过程析出了氯化钠,故答案为:粗产品中结晶水含量低(或粗产品中混有氯化钠杂质);
(6)草酸钴晶体为![]() ,计算可知150~210℃时,
,计算可知150~210℃时, ![]() ,可知此时失去全部结晶水;210~290℃时,气体产物为CO2,此时根据质量守恒可求得2.41g固体中含O原子
,可知此时失去全部结晶水;210~290℃时,气体产物为CO2,此时根据质量守恒可求得2.41g固体中含O原子![]() ,故产物为Co3O4或者CoO·Co2O3,故答案为:Co3O4(或 CoO·Co2O3)
,故产物为Co3O4或者CoO·Co2O3,故答案为:Co3O4(或 CoO·Co2O3)

【题目】CO在工农业生产及科学研究中有着重要的应用。
(1)CO催化脱硫:科学研究发现CoS对CO还原SO2实现脱硫、并回收S有很好的催化效果,该反应的化学方程式为__________。
(2)CO催化脱氮:在一定温度下,向2 L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化制作用下发生反应:2NO2(g)+4CO(g)![]() N2(g)+4CO2(g) ΔH=-1227.8 kJ/mol,测得相关数据如下:
N2(g)+4CO2(g) ΔH=-1227.8 kJ/mol,测得相关数据如下:
时间 浓度 | 0 min | 5 min | 10 min | 15 min | 20 min |
c(NO2)/mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5 min内NO2的转化率将_____(填“变大”“变小”或“不变”)。
②下列表述能说明该反应已达到平衡状态的是______(填序号)。
A.CO的化学反应速率为N2的4倍 B.气体的颜色不再变化
C.化学平衡常数K不再变化 D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是_____(填序号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂。Ni的羰化反应为Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0,T0温度下,将足量的Ni粉和3.7 mol CO加入到刚性密闭容器中,10 min时反应达到平衡,测得体系的压强为原来的
Ni(CO)4(g) ΔH<0,T0温度下,将足量的Ni粉和3.7 mol CO加入到刚性密闭容器中,10 min时反应达到平衡,测得体系的压强为原来的![]() 。则:
。则:
①0~10 min内平均反应速率v(Ni)=___g·min-1。
②研究表明,正反应速率v正=k正·x4(CO),逆反应速率v逆=k逆·x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的![]() =__。
=__。
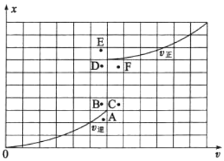
③T1温度下测得一定的实验数据,计算得到v正~x(CO)和v逆~x[Ni(CO)4]的关系如图所示。当降低温度时,反应重新达到平衡,相应的点分别为_______、_______(填字母)。
【题目】绿矾中FeSO4·7H2O含量的测定,若用容量法测定绿矾中FeSO4·7H2O的含量。滴定反应是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O。
实验方案如下:①称取15.041g绿矾产品,溶解,在250mL容量瓶中定容。
②量取25.00mL 待测溶液于锥形瓶中。
③用0.0500mol/LKMnO4溶液(硫酸酸化)滴定至终点,记录初读数和末读数。
④ 。
⑤ 数据处理。
(1)上述实验方案中的步骤④是______。洁净的滴定管在滴定前必须进行的操作有:
①检验活塞是否漏水;
②_______;
③向滴定管中加入KMnO4标准溶液到0刻度以上,赶走尖嘴部位的气泡,调节初读数。
(数据处理)某小组同学的实验数据记录如下:
实验次数 | 初读数(mL) | 末读数(mL) |
1 | 0.20 | 21.40 |
2 | 0.00 | 21.00 |
3 | 1.60 | 26.60 |
(2)上述样品中FeSO4·7H2O的质量分数为_______(用小数表示,保留三位小数)。
