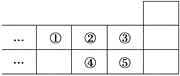
题目内容
【题目】X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如下图所示。已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。下列说法正确的是
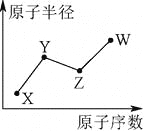
A. Y、Z、W处于同一周期
B. Y、W的最简单氢化物的水溶液能相互反应
C. 非金属性:Y<Z
D. X、Z、W形成的化合物均为强酸
【答案】BC
【解析】试题分析:X、Y、Z、W是四种常见的短周期元素,Y、Z两种元素的单质是空气的主要成分,Z的原子序数大于Y,可推知Z为O、Y为N,W原子的最外层电子数与Ne原子的最外层电子数相差1,则W最外层电子数为7,原子半径大于O原子半径,故W为Cl元素;X的原子序数小于N,而原子半径大于N,故X为H元素,A、Y(N)、Z(O)为第二周期元素、W(Cl)为第三周期元素,不处于同一周期, A错误;B、Y、W的最简单氢化物的水溶液NH3、HCl能相互反应, B正确;C、非金属性:Y(N)<Z(O),C正确;D、X、Z、W形成的化合物有H2O、HClO都不是强酸, D错误。答案选BC。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目