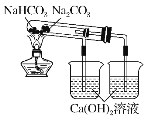
��Ŀ����
����Ŀ������������Ű�����ཡ������������Ӱ�죮ȼú������β������ɿ�����Ⱦ��ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ��2NO��g��+2CO![]() 2CO2��g��+N2��g����H��O
2CO2��g��+N2��g����H��O
����Ӧ������ʱ��������ͼ1��ʾ���������������䣬���ڷ�Ӧǰ������ʵĴ�����������ʱ��ͼ����ͼ2��ʾ������˵����ȷ���� �����Ӧ��ĸ����

A��a1��a2
B��b1��b2
C��t1��t2
D��ͼ2����Ӱ�����������
E��ͼ1����Ӱ�����������
�����÷�Ӧ�ھ��ȡ����ݵ��ܱ���ϵ�н��У�����ʾ��ͼ��ȷ����˵����Ӧ�ڽ��е�t1ʱ�̴ﵽƽ��״̬���� ������ţ�

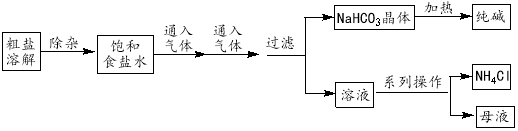
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⣮úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
��֪��CH4��g��+2NO2��g��![]() N2��g��+CO2��g��+2H2O��g����H=��867kJ/mol
N2��g��+CO2��g��+2H2O��g����H=��867kJ/mol
2NO2��g��![]() N2O4��g����H=��56.9kJ/mol H2O��g��=H2O��l����H=��44.0kJ/mol
N2O4��g����H=��56.9kJ/mol H2O��g��=H2O��l����H=��44.0kJ/mol
д��CH4����ԭN2O4��g������N2��H2O��l�����Ȼ�ѧ����ʽ�� ��
��3��CH4��H2O��g�� �ڴ������淢����ӦCH4+H2OCO+3H2���÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ�������
�¶�/�� | 800 | 1000 | 1200 | 1400 |
ƽ�ⳣ�� | 0.45 | 1.92 | 276.5 | 1771.5 |
���÷�Ӧ�� ��Ӧ������ȡ����ȡ�����
��T��ʱ����1L�ܱ�������Ͷ��l mol CH4��l mol H2O��g����ƽ��ʱc��CH4��=0.5mol/L�����¶��·�ӦCH4+H2O![]() CO+3H2��ƽ�ⳣ��K= ��
CO+3H2��ƽ�ⳣ��K= ��
��4������ȼ�ϵ�ؿ����������������ʣ���ͼ�����ü���ȼ�ϵ�ص��100ml1mol/Lʳ��ˮ�����һ��ʱ����ռ�����״���µ�����2.24L���������Һ������䣩��
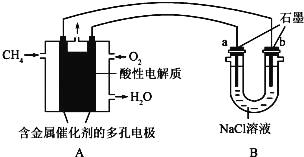
������ȼ�ϵ�صĸ�����Ӧʽ��
��������Һ��pH= ����������������������Һ��Ӧ��
�������������������ڱ�״������ L��
���𰸡���1����BC����BD��
��2��CH4��g��+N2O4��g���TN2��g��+2H2O��l��+CO2��g����H=��898.1kJ/mol��
��3����������K=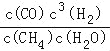 =
=![]() =6.75��
=6.75��
��4��CH4��8e��+2H2O=CO2+8H+����14����1.68��
��������
�����������1����ʹ�ô�����ֻ�ӿ췴Ӧ���ʣ��ﵽƽ������ʱ���٣����a1<a2��b2>b1��t1>t2�������Ի�ѧƽ����Ӱ�죬������Ӱ�����ȣ���ѡ��BC��ȷ����A������Ӧ�Ƿ��ȷ�Ӧ�������Ǿ������������ŷ�Ӧ���У��¶����ߣ���Ӧ���������ﵽƽ�ⷴӦ���ʲ��ٸı䣬������ͼ��t1ʱ�̺�Ӧ���ʻ��ڸı䣬˵��t1ʱ��û�дﵽƽ�⣬�ʴ���B��t1ʱ�̣����ٸı䣬˵����Ӧ�ﵽƽ�⣬����ȷ��C��t1ʱ�̣��ﵽƽ�⣬���ʵ������ٸı䣬������ͼ��t1ʱ�̺����ʵ������ڷ����仯��˵��û�дﵽƽ�⣬�ʴ���D�����ݻ�ѧƽ��״̬�Ķ��壬�ﵽƽ�⣬����������ٸı䣬����ͼ��t1ʱ�̴ﵽƽ�⣬����ȷ��(2)��CH4��g��+2NO2��g��![]() N2��g��+CO2��g��+2H2O��g������2NO2��g��
N2��g��+CO2��g��+2H2O��g������2NO2��g��![]() N2O4��g������H2O��g��=H2O��l����CH4��N2O4=N2��2H2O��CO2���������������3�������ó��� CH4��g��+N2O4��g���TN2��g��+2H2O��l��+CO2��g����H=��898.1kJ/mol��(3)����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ������ݣ������¶ȵ����ߣ�ƽ�ⳣ������˵��������Ӧ������У�������Ӧ�����ȷ�Ӧ��
N2O4��g������H2O��g��=H2O��l����CH4��N2O4=N2��2H2O��CO2���������������3�������ó��� CH4��g��+N2O4��g���TN2��g��+2H2O��l��+CO2��g����H=��898.1kJ/mol��(3)����ѧƽ�ⳣ��ֻ���¶ȵ�Ӱ�죬���ݱ������ݣ������¶ȵ����ߣ�ƽ�ⳣ������˵��������Ӧ������У�������Ӧ�����ȷ�Ӧ��
�� CH4+H2O![]() CO+3H2
CO+3H2
��ʼ��1 1 0 0
�仯��x x x 3x
ƽ�⣺1��x 1��x x 3x��
���ݼ����Ũ�����x=0.5��K=c3(H2)��c(CO)/[c(H2O)��C(CH4)]= ![]() =6.75����4�������������ԣ���˸�����ӦʽΪCH4��2H2O��8e��=CO2��8H������ ��ⱥ��ʳ��ˮ��2NaCl��2H2O
=6.75����4�������������ԣ���˸�����ӦʽΪCH4��2H2O��8e��=CO2��8H������ ��ⱥ��ʳ��ˮ��2NaCl��2H2O![]() 2NaOH��H2����Cl2����100��10��3��1molNaClȫ����⣬�������������ʵ���Ϊ0.05mol�������NaCl���һ����ˮ��2H2O
2NaOH��H2����Cl2����100��10��3��1molNaClȫ����⣬�������������ʵ���Ϊ0.05mol�������NaCl���һ����ˮ��2H2O![]() 2H2����O2��������n(OH��)=0.05��2mol=0.1mol ��c(OH��)=0.1��100��10��3mol��L��1=1����c(H��)=10��14mol��L��1����pH=14�����������ķ����������ϲ�����������Ϊ(0.05��0.05/2)��22.4L=1.68L��
2H2����O2��������n(OH��)=0.05��2mol=0.1mol ��c(OH��)=0.1��100��10��3mol��L��1=1����c(H��)=10��14mol��L��1����pH=14�����������ķ����������ϲ�����������Ϊ(0.05��0.05/2)��22.4L=1.68L��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�