题目内容
6.化学与生活密切相关,下列说法错误的是( )| A. | 碳酸钠和碳酸氢钠均可用作食用碱 | B. | 液氮可用作制冷剂 | ||
| C. | 二氧化硫可用于食品增白 | D. | 漂粉精可用于环境杀菌消毒 |
分析 A.碳酸钠和碳酸氢钠都是弱碱,无毒,能够用作食品添加剂;
B.液氮气化要吸收大量的热量,使周围温度降低;
C.二氧化硫有毒;
D.漂粉精是次氯酸盐,在水溶液中水解生成次氯酸,具有强氧化性,能消毒杀菌.
解答 解:A.碳酸钠(Na2CO3)和碳酸氢钠(NaHCO3)都可作为食用碱,故A正确;
B.液氮气化要吸收大量的热量,使周围温度降低,所以常用作冷冻剂,可用作制冷剂,故B正确;
C.二氧化硫有毒,不能用作食品漂白剂,故C错误;
D.漂粉精是次氯酸盐,在水溶液中水解生成次氯酸,具有强氧化性,能消毒杀菌,可用于环境消毒,故D正确;
故选:C.
点评 本题考查了物质的用途,性质决定用途,熟悉物质的性质是解题关键,题目难度不大.

练习册系列答案
相关题目
17.下列溶液中,溶质的物质的量浓度为1mol•L-1的是( )
| A. | 将40gNaOH溶解于1L水中配成的NaOH溶液 | |
| B. | 将80gSO3溶于水并配成1L的溶液 | |
| C. | 将0.5mol•L-1的NaNO3溶液100ml 加热蒸发掉50g水后的溶液 | |
| D. | 1L含K+为1mol的K2SO4溶液 |
14.除去下列各物质中的少量杂质(括号中的物质为杂质),所选试剂和方法都正确的是( )
| 物质 | 除杂试剂 | 除杂方法 | |
| A | 乙烷(乙烯) | 氢气 | 加热 |
| B | 乙酸(乙醇) | 氢氧化钠溶液 | 蒸发 |
| C | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 分液 |
| D | 溴苯(苯) | 溴水 | 常温 |
| A. | A | B. | B | C. | C | D. | D |
1.“即食即热型快餐”适合外出时使用.其内层是用铝箔包裹并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,放出的热量便可对食物进行加热,这两包化学物质最合适的选择是( )
| A. | 氯化钠与水 | B. | 生石灰与水 | C. | 铁粉和浓硝酸 | D. | 浓硫酸与水 |
11.元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下表所列是五种短周期元素的原子半径及主要化合价(已知锂的原子半径为0.152nm).
(1)用元素符号标出A、B、C、D四种元素在元素周期表(如表)中的位置;
(2)E元素处于周期表中的第二周期第ⅣA族;
(3)A、B、D的简单离子的半径由大到小的顺序为Cl->O2->Mg2+(填离子符号);
(4)用电子式表示化合物DB2形成的过程: ;
;
(5)F为E的同族相邻元素,其非金属性:E>F(填“>”或“<”),设计一个简单实验加以验证:将二氧化碳通入硅酸钠溶液中,有胶状物生成,证明碳酸的酸性比硅酸强,则碳元素的非金属性比硅元素强(简要说明实验步骤、现象和仪器自选).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.074 | 0.099 | 0.110 | 0.160 | 0.077 |
| 主要化合价 | -2 | +7、-1 | +5,-3 | +2 | +4、-4 |
(2)E元素处于周期表中的第二周期第ⅣA族;
(3)A、B、D的简单离子的半径由大到小的顺序为Cl->O2->Mg2+(填离子符号);
(4)用电子式表示化合物DB2形成的过程:
 ;
;(5)F为E的同族相邻元素,其非金属性:E>F(填“>”或“<”),设计一个简单实验加以验证:将二氧化碳通入硅酸钠溶液中,有胶状物生成,证明碳酸的酸性比硅酸强,则碳元素的非金属性比硅元素强(简要说明实验步骤、现象和仪器自选).

18.下列变化过程中,一定放出能量的是( )
| A. | 化合物的分解 | B. | 可燃物的燃烧 | C. | 液体的气化 | D. | 固体的溶解 |
15.随着社会的发展,人类日益重视环境问题,下列做法正确的是( )
| A. | 采用“绿色化学”工艺,使原料尽可能完全转化为所需要的物质 | |
| B. | 大量使用农药和化肥,提高农作物的产量 | |
| C. | 将氟利昂大量用于冰箱、空调的制冷剂 | |
| D. | 将废弃的植物油(即“地沟油”)蒸馏可以重新作为食用油 |
 能源与材料、信息一起被称为现代社会发展的三大支柱,现代社会的一切活动都离不开能源,能源的利用与相互转化始终与我们息息相关.
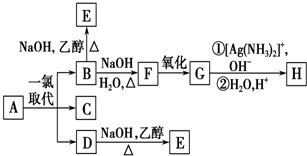
能源与材料、信息一起被称为现代社会发展的三大支柱,现代社会的一切活动都离不开能源,能源的利用与相互转化始终与我们息息相关.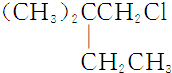 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如下所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如下所示.