题目内容
12.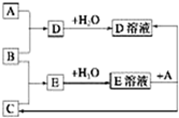 已知A、B、C为中学化学中常见的单质,室温下A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.下列说法正确的是( )
已知A、B、C为中学化学中常见的单质,室温下A为固体,B和C均为气体.在适宜的条件下,它们可以按如图框图进行反应.下列说法正确的是( )| A. | A、B、C中三种元素的任意两种元素形成的化合物所属物质类别可能是氧化物 | |
| B. | A、B、C中有一种金属且为B | |
| C. | 如果E溶液是一种强酸,则E溶液为硫酸 | |
| D. | A、B、C中三种元素的任意两种元素形成的化合物所属物质类别一定不是碱 |
分析 已知A、B、C为中学化学中常见的单质,室温下,A为固体,B和C均为气体.在适宜的条件下,它们可以按如图所示进行反应,A为固体,常见为碳、钠、镁、铝、铁等,B、C为气体单质,常见有氯气、氧气、氢气、氮气等,固体A和气体B反应生成的D是固体,说明A为金属不为碳,E溶液能与金属反应,且E是两种气体反应所得产物,则E应为酸,C应为氢气,所以B为Cl2,E为HCl,D为金属和盐酸反应生成的氯化物盐,此盐可以直接由A和Cl2反应得到,说明则A一定不是变价金属铁,A可能是Na、Mg、Al等,结合选项来解答.
解答 解:由信息及上述转化关系可知,B为Cl2,E为HCl,C为氢气,D为金属和盐酸反应生成的氯化物盐,此盐可以直接由A和Cl2反应得到,说明则A一定不是变价金属铁,A可能是Na、Mg、Al等,
A.若A为Na,B为氯气,C为氢气,三种元素中的任意两种元素形成的化合物一定不含O元素,不属于氧化物,故A错误;
B.由上述分析可知,只有A为金属,B和C均为气体非金属单质,故B错误;
C.E为两种单质化合生成的物质,溶于水显酸性,不可能为硫酸,故C错误;
D.若A为Na,B为氯气,C为氢气,三种元素中的任意两种元素形成的化合物一定不含O元素,不可能为碱,故D正确;
故选D.
点评 本题考查无机物的推断,为高频考点,把握常见物质的性质、物质之间的转化反应为解答的关键,侧重分析、推断能力的综合考查,注意A为金属的分析为解答的难点,题目难度中等.

练习册系列答案
相关题目
11.元素周期表是学习化学的重要工具,它隐含着许多信息和规律,下表所列是五种短周期元素的原子半径及主要化合价(已知锂的原子半径为0.152nm).
(1)用元素符号标出A、B、C、D四种元素在元素周期表(如表)中的位置;
(2)E元素处于周期表中的第二周期第ⅣA族;
(3)A、B、D的简单离子的半径由大到小的顺序为Cl->O2->Mg2+(填离子符号);
(4)用电子式表示化合物DB2形成的过程: ;
;
(5)F为E的同族相邻元素,其非金属性:E>F(填“>”或“<”),设计一个简单实验加以验证:将二氧化碳通入硅酸钠溶液中,有胶状物生成,证明碳酸的酸性比硅酸强,则碳元素的非金属性比硅元素强(简要说明实验步骤、现象和仪器自选).
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.074 | 0.099 | 0.110 | 0.160 | 0.077 |
| 主要化合价 | -2 | +7、-1 | +5,-3 | +2 | +4、-4 |
(2)E元素处于周期表中的第二周期第ⅣA族;
(3)A、B、D的简单离子的半径由大到小的顺序为Cl->O2->Mg2+(填离子符号);
(4)用电子式表示化合物DB2形成的过程:
 ;
;(5)F为E的同族相邻元素,其非金属性:E>F(填“>”或“<”),设计一个简单实验加以验证:将二氧化碳通入硅酸钠溶液中,有胶状物生成,证明碳酸的酸性比硅酸强,则碳元素的非金属性比硅元素强(简要说明实验步骤、现象和仪器自选).

12.下列依据热化学方程式得出的结论正确的是( )
| A. | 由C(s,石墨)═C(s,金刚石)△H>0可知,金刚石比石墨稳定 | |
| B. | CO(g)的燃烧热是283.0kJ•mol-1,则2CO2(g)═2CO(g)+O2(g)反应的△H=+283.0kJ•mol-1 | |
| C. | 已知C(s)+O2(g)═2CO2(g)△H1;C(s)+$\frac{1}{2}$O2(g)═CO(g)△H2,则△H1>△H2 | |
| D. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H<0,该反应的化学能可以转化为电能 |
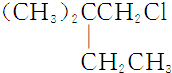 .B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如下所示.
.B和D分别与强碱的醇溶液共热,都只能得到有机化合物E.以上反应及B的进一步反应如下所示.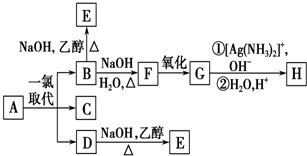
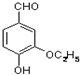 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.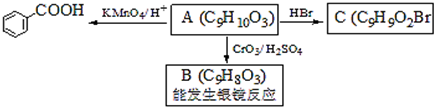
 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型).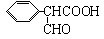 .
.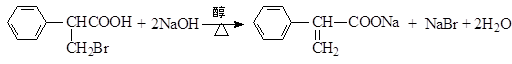 .
.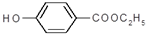 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用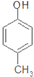 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
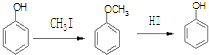
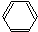 $→_{H_{2},△}^{催化剂}$
$→_{H_{2},△}^{催化剂}$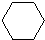 $→_{Br_{2}}^{光照}$
$→_{Br_{2}}^{光照}$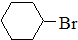
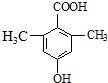 .
.