题目内容
6.烷烃完全燃烧都可以生成CO2和H2O.现以甲烷、乙烷、丙烷三种物质燃烧为例,进行燃烧分析.(1)取等物质的量的三种物质,在O2中完全燃烧,生成CO2最多的是丙烷,生成H2O最多的是丙烷,消耗O2最多的是丙烷.由此可以得出结论:等物质的量的烷烃完全燃烧,生成CO2、H2O以及消耗O2的量随着分子中碳原子数的增多而变大.
(2)取等质量的三种物质,在O2中完全燃烧,生成CO2最多的是丙烷,生成H2O最多的是甲烷,消耗O2最多的是甲烷.由此可以得出结论:等质量的烷烃完全燃烧,生成CO2的量随着分子中碳的质量分数的增大而变大,生成水的量随着分子中氢的质量分数的增大而变大,消耗O2的量随着分子中氢的质量分数的增大而变大.
分析 (1)等物质的量的以上物质燃烧时,分子中C、H原子数目越大,生成CO2、水越多;烃(CxHy)的物质的量相等,完全燃烧耗氧量取决于(x+$\frac{y}{4}$)值,该值越大,耗氧量越多消耗的氧气越多;
(2)等质量的烃完全燃烧,C的质量分数越大,生成的二氧化碳越多,H元素质量分数越大,生成的水越多,耗氧量越大.
解答 解:(1)等物质的量的以上物质燃烧时,分子中C、H原子数目越大,生成CO2、水越多,则生成CO2最多的是丙烷,生成的水最多的是丙烷;烃(CxHy)的物质的量相等,完全燃烧耗氧量取决于(x+$\frac{y}{4}$)值,该值越大,耗氧量越多消耗的氧气越多,则耗氧量最大的是丙烷;由此可以得出结论:等物质的量的烷烃完全燃烧,生成CO2、H2O以及消耗O2的量随着 分子中碳原子数的增多而变大
故答案为:丙烷;丙烷;丙烷;分子中碳原子数;
(2)等质量的烃完全燃烧,C的质量分数越大,生成的二氧化碳越多,丙烷中碳的质量分数为$\frac{36}{36+8}$,乙烷中碳的质量分数为$\frac{24}{24+6}$,甲烷中碳的质量分数为$\frac{12}{12+4}$,则丙烷的碳的质量分数最大,生成的二氧化碳最多;H元素质量分数越大,生成的水越多,耗氧量越大,甲烷中碳的质量分数最小,则氢的质量分数最大,所以甲烷消耗的氧气最多,生成的水最多;由此可以得出结论:等质量的烷烃完全燃烧,生成CO2的量随着 分子中碳的质量分数的增大而变大,生成水的量随着 分子中氢的质量分数的增大而变大,消耗O2的量随着 分子中氢的质量分数的增大而变大,
故答案为:丙烷;甲烷;甲烷;分子中碳的质量分数;分子中氢的质量分数;分子中氢的质量分数.
点评 本题考查有机物燃烧有关计算,难度不大,注意根据燃烧通式及元素质量分数理解烃耗氧量.

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案| A. | 化学键是一种作用力 | |
| B. | 化学键可以使离子相结合,也可以使原子相结合 | |
| C. | 非极性键不是化学键 | |
| D. | 化学反应过程中,反应物分子内的化学键断裂,产物分子中的化学键形成 |
| A. | 溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓ | |
| B. | 用醋酸除水垢:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 利用腐蚀法制作印刷线路板:Fe3++Cu=Fe2++Cu2+ | |
| D. | 实验室用溴和苯在催化剂作用下制溴苯: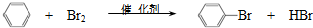 |
| A. | Cl2与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | H2SO4与Ba(OH)2反应:Ba2++SO42-═BaSO4 | |
| C. | 足量铁溶于稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++3NH3•H2O═Al(OH)3 |
| A. | 将pH=5的醋酸溶液稀释后,恢复至原温度,pH和Kw均增大 | |
| B. | 25℃时,pH=3的氯化铵溶液中:c(OH-)=1.0×10-11mol•L-1 | |
| C. | 25℃时,pH=4的氯化铵溶液中:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 向NH4HSO4溶液中加入等物质的量的NaOH形成的溶液中:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| A. | 乙烷不能使酸性高锰酸钾褪色,故苯乙烷也不能使酸性高锰酸钾褪色 | |
| B. | 乙醛与乙酸都含有碳氧双键,故都能与H2发生加成反应 | |
| C. | 甲酸钠结构中含有醛基,能发生银镜反应,故甲酸甲酯也能发生银镜反应 | |
| D. | 甲烷与氯气在光照下反应可生成一氯甲烷,甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
| A. | 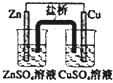 如装置中,盐桥中的K+移向CuSO4溶液 | |
| B. | 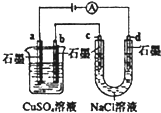 如图装置中b极析出6.4g固体时,d极产生2.24LH2 | |
| C. | 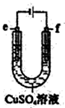 用如图装置精炼铜时,f极为粗铜 | |
| D. | 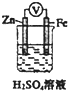 如图装置中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
