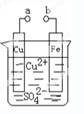
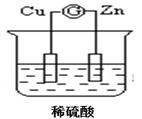
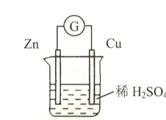
题目内容
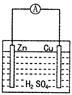
按下图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)
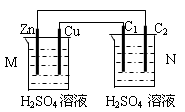

| A.C1上发生还原反应 |
| B.M 装置中SO42-移向Cu电极 |
| C.工作一段时间后装置M 中溶液pH变大,装置N中溶液pH变小 |
| D.Cu电极与C2电极上的电极反应相同 |
CD
试题分析:M装置中Zn、Cu电极的活泼性不同,与硫酸溶液形成原电池,Zn是负极,Cu是正极,N装置为电解池,C1与正极相连,则C1是阳极,阳极上发生氧化反应,故A错误;原电池内电路中,硫酸根是阴离子,阴离子移向负极,则硫酸根离子移向Zn电极,氢离子是阳离子,阳离子移向正极,故B错误;负极反应式为Zn—2e-=Zn2+,正极反应式为2H++2e-=H2↑,电池总反应为Zn+2H+=Zn2++H2↑,氢离子浓度逐渐减小,因此工作一段时间后M装置中溶液pH增大,N中用惰性电极电解硫酸溶液,实质就是电解水,硫酸浓度逐渐增大,酸性增强,溶液pH减小,故C正确;C2与负极相连,则C2是阴极,硫酸溶液中氢离子是阳离子,阳离子移向阴极,阴极上发生氧化反应,即2H++2e-=H2↑,故D正确。

练习册系列答案
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案
相关题目
 2Fe2+I2设计成如下图所示的原电池。下列说法不正确的是
2Fe2+I2设计成如下图所示的原电池。下列说法不正确的是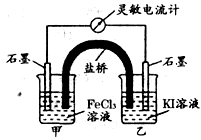
 O2+H2O+2e- =2OH- ,据此判断锌片是
O2+H2O+2e- =2OH- ,据此判断锌片是
 →
→ ↑
↑ →
→