题目内容
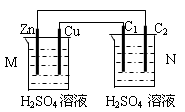
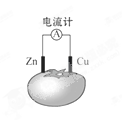
如图所示的原电池装置中,锌为 极,电极发生的是 反应(填氧化或还原),电极反应式为 ;铜电极反应式为 ,铜片上观察到的现象为 。
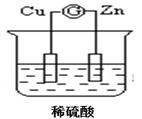

(5分) 负 氧化 Zn-2e-=Zn2+ 2H++2e-=H2↑ 铜片表面有气泡出现
试题分析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。根据装置图可知,锌的金属性强于铜,所以锌是负极,失去电子,发生氧化反应,电极反应式是Zn-2e-=Zn2+;铜是正极,溶液中的氢离子在正极得到电子,发生还原反应,电极反应式是2H++2e-=H2↑,所以铜片上观察到的现象为铜片表面有气泡出现。
点评:该题是基础性试题的考查,难度不大。明确原电池的工作原理,是答题的关键,有利于调动学生的学习兴趣,激发学生的学习积极性。

练习册系列答案
 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目
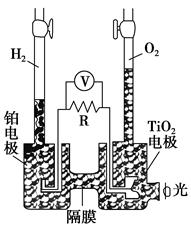
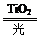 2H2↑+O2↑,该过程类似植物的光合作用。下图是光照射下TiO2分解水的装置示意图。下列叙述正确的是 ( )
2H2↑+O2↑,该过程类似植物的光合作用。下图是光照射下TiO2分解水的装置示意图。下列叙述正确的是 ( )