题目内容
8.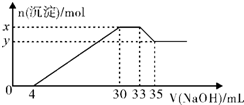 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )| A. | 原溶液中n(Mg2+):n(Al3+)=5:1 | B. | 原溶液的c(H+)=0.1mol•L-1 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.85mol•L-1 |
分析 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=$\frac{0.004L×5mol/L}{0.2L}$=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则c(NH4+)=$\frac{(0.033-0.03)×5mol/L}{0.2L}$=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,则c(Mg2+)=$\frac{\frac{0.02L×5mol/L}{2}}{0.2L}$=0.25mol/L,c(Al3+)=$\frac{0.002L×5mol/L}{0.2L}$=0.05mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,以此来解答.
解答 解:在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol•L-1的NaOH溶液,加入4mLNaOH溶液时没有沉淀生成,说明H+先和NaOH反应,则溶液中含有H+,c(H+)=$\frac{0.004L×5mol/L}{0.2L}$=0.1mol/L,继续滴加NaOH溶液,沉淀的量逐渐增大,30mLNaOH溶液后,继续滴加NaOH溶液,沉淀的物质的量不变,则溶液中含有NH4+,则c(NH4+)=$\frac{(0.033-0.03)×5mol/L}{0.2L}$=0.075mol/L,继续滴加NaOH,沉淀溶解,35mLNaOH后,沉淀不溶解,说明溶液中含有Mg2+、Al3+,根据Al3++3OH-=Al(OH)3↓、Al(OH)3+OH-=AlO2-+2H2O知,生成氢氧化铝沉淀和生成偏铝酸根离子需要氢氧化钠体积之比为3:1,则生成氢氧化铝沉淀需要NaOH体积=(35-33)mL×3=6mL,则生成氢氧化镁需要NaOH体积=(30-4mL)-6mL=20mL,则c(Mg2+)=$\frac{\frac{0.02L×5mol/L}{2}}{0.2L}$=0.25mol/L,c(Al3+)=$\frac{0.002L×5mol/L}{0.2L}$=0.05mol/L,
溶液中存在电荷守恒,根据电荷守恒得3c(Al3+)+2c(Mg2+)+C(NH4+)+c(H+)=c(Cl-)=[3×0.05+2×0.25+0.075+0.1]mol/L=0.825mol/L,
A.c(Mg2+)=0.25mol/L,c(Al3+)=0.05mol/L,同一溶液中体积相等,其物质的量之比等于物质的量浓度之比=0.25mol/L:0.05mol/L=5:1,故A正确;
B.由上述分析可知,c(H+)=0.1mol/L,故B正确;
C.x为Al(OH)3、Mg(OH)2的物质的量,y为Mg(OH)2的物质的量,二者的差为Al(OH)3的物质的量=0.05mol/L×0.2L=0.01mol,故C正确;
D.原来溶液中c(Cl-)=0.825mol/L,故D错误;
故选D.
点评 本题考查离子反应的计算,为高频考点,明确离子反应先后顺序、图中线、面、点的意义为解答的关键,注意铝离子转化为氢氧化铝沉淀、偏铝酸钠时消耗NaOH的体积之比,并结合电荷守恒解答,侧重分析与计算能力的考查,题目难度中等.

 发散思维新课堂系列答案
发散思维新课堂系列答案| A. | 50mL 1 mol/L NaCl溶液 | B. | 75 mL 2 mol/L CaCl2溶液 | ||
| C. | 50mL 2 mol/L KCl溶液 | D. | 75 mL 1 mol/L AlCl3溶液 |
| A. | CO2通入BaCl2溶液中无明显现象,说明碳酸的酸性比盐酸弱 | |
| B. | 氯水加入稀盐酸和AgNO3溶液产生白色沉淀,说明有氯水中有Cl-存在 | |
| C. | 常温下,Cu片投入到浓硫酸中不反应,因为浓硫酸使Cu产生钝化现象 | |
| D. | 浓硫酸具有脱水性,因而能使胆矾失去结晶水由蓝色变白色 |
| A. | 由二氧化碳和氧气组成的混合气体共有NA个分子,其中氧原子数为2NA | |
| B. | 1mol铜与足量稀硝酸反应可产生NO分子$\frac{2}{3}$NA个. | |
| C. | 12g金刚石中含有共价键数为4NA | |
| D. | 1L1mol/L硫酸铝溶液中阴阳离子总数大于5NA. |
| A. | K+ Na+ HSO3- Cl- | B. | Na+ Ba2+[Al(OH)4]- NO3- | ||
| C. | NH4+ K+ Cl- NO3- | D. | Fe2+ Na+ ClO- S2- |
| A. | 25g质量分数68%的H2O2水溶液中含氧原子数目为NA | |
| B. | 0.1mol•L-1 NH4Cl溶液中含有NH4+的数目小于0.1NA | |
| C. | 100mL 12mol•L-1 的浓HNO3与过量Cu反应转移电子的数目为0.6NA | |
| D. | 标准状况下,11.2L由C2H4和C3H4 组成的混合气体中含有氢原子的数目为2NA |
| A. | 四氯化碳的电子式: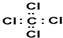 | B. | 氢氧根的电子式: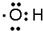 | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 乙醇的结构简式:CH3CH2OH |
| A. | CO2 | B. | H2 | C. | C5H12 | D. | NO |
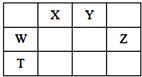 如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22.下列说法正确的是( )| A. | X、Y、Z三种元素最低价氢化物的沸点依次升高 | |
| B. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| C. | 物质WY2、W3X4均有熔点高、硬度大的特性 | |
| D. | T元素的单质不具有半导体的特性,T与Z元素可形成化合物TZ4 |