题目内容
20.有关化学用语正确的是( )| A. | 四氯化碳的电子式: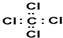 | B. | 氢氧根的电子式: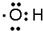 | ||
| C. | 乙烯的结构简式:CH2CH2 | D. | 乙醇的结构简式:CH3CH2OH |
分析 A、四氯化碳中碳原子和氯原子均达到了8电子稳定结构;
B、氢氧根为带一个负电荷的阴离子,阴离子的电子式有括号;
C、乙烯或者含有碳碳双键,双键在结构简式中不能省略;
D、根据结构简式的书写方法来回答.
解答 解:A、四氯化碳中碳原子和氯原子均达到了8电子稳定结构,氯原子的核外电子分布情况要画出,正确应为: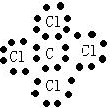 ,故A错误;
,故A错误;
B、氢氧根中氧原子达到了8电子稳定结构,氢原子达到了2电子稳定结构,阴离子的电子式要加上括号,正确应为: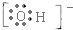 ,故B错误;
,故B错误;
C、乙烯的最简式(实验式)为CH2,分子式为C2H4,结构简式为:CH2=CH2,故C错误;
D、乙醇的结构简式为:CH3CH2OH,故D正确.故选D.
点评 本题考查学生电子式、结构简式、最简式的书写知识,可以根据所学知识进行回答,难度不大.

练习册系列答案
相关题目
10.下列物质中,属于纯净物的是( )
| A. | 溴苯 | B. | 铝热剂 | C. | 石油 | D. | 水煤气 |
11.100mL 6mol•L-1H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A. | 碳酸钠(固体) | B. | 少量硫酸铜溶液 | C. | NaCl溶液 | D. | 加热 |
8.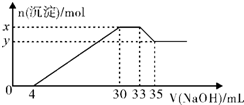 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )
 在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )
在200mL含Mg2+、Al3+、NH4+、H+、Cl-等离子的溶液中,逐滴加入5mol/L的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列叙述不正确的是( )| A. | 原溶液中n(Mg2+):n(Al3+)=5:1 | B. | 原溶液的c(H+)=0.1mol•L-1 | ||
| C. | x与y的差值为0.01mol | D. | 原溶液中c(Cl-)=0.85mol•L-1 |
15.下列化合物不是离子化合物的是( )
| A. | SiO2 | B. | KHCO3 | C. | NH4Br | D. | NaOH |
5.元素周期表和元素周期律对于其他与化学相关的科学技术有指导作用.下列说法中不正确的是( )
| A. | 在元素周期表左下方区域的金属元素中寻找半导体材料 | |
| B. | 利用元素周期表中氟、氯、硫、磷附近的元素研制新型农药 | |
| C. | 在过渡金属中寻找催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 在周期表一定区域内寻找元素、发现物质的新用途是一种相当有效的方法 |
12.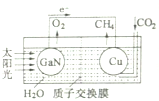 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )
 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )| A. | 该装置是将化学能转化为电能 | |
| B. | 氮化镓电极是正极 | |
| C. | 铜电极表面的电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| D. | 可用盐酸作该装置的电解液 |
3.25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的( )
| A. | pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) | |
| B. | pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) | |
| C. | V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+) | |
| D. | V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
4.关于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 过渡元素是副族和第Ⅷ族元素的总称 |