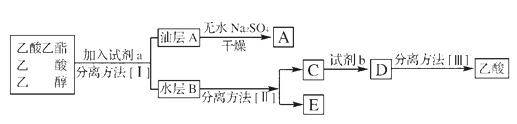
��Ŀ����
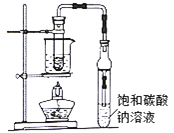
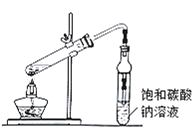
����Ŀ�����Ȼ��ѳ�����Ϊ��ɫҺ�壬�۵㣭23.2�棬�е�136.4�棬����ˮ�⡣��900��ʱ��������ͨ��������(��Ҫ�ɷ���FeTiO3)��̿�۵Ļ����ɷ�Ӧ�������Ȼ��Ѻ��Ȼ���(�۵�306�棬�е�315��)��ͬʱ����һ���ж����塣����ȡ���ռ����Ȼ��ѵ�װ����ͼ��ʾ(�г�װ����ȥ)��
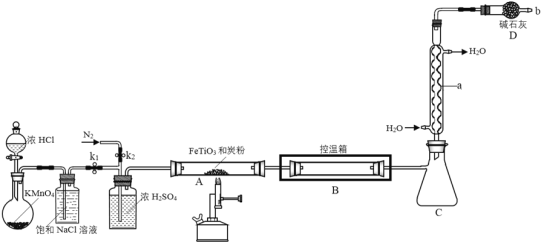
�ش��������⣺
(1)����a��������____����װ��������û���Լ���Ӧǰ��Ӧ�ý��еIJ�����_____��
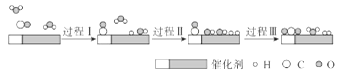
(2)��Ӧ��ʼǰ���Ƚ���������飬�����Թ�����̿�ۻ�Ͼ��ȣ��Ƴɶ��״�������Ŀ����______________��
(3)ʵ������ͨ��N2���Σ��ڶ���ͨN2��������_________��
(4)900��ʱ��Aװ���з�����Ӧ�Ļ�ѧ����ʽΪ__________��
(5)Bװ���п������¶���150��200�棬Ŀ����___________��
(6)װ��b�����ڵ�ȱ����________________��
(7)����TiCl4���ȳ�ʪ�����С����̡�����TiO2xH2O����Ӧ����ʽΪ_________��
���𰸡����������� ���װ�õ������� ����Ӵ������ʹ��Ӧ����֣�̿���Թ�������������������� �����ɵ�TiCl4������ȫ����Cװ���� 2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO ����������FeCl3���壬��ȥFeCl3 ȱ������CO��ֹ��Ⱦ������װ�� TiCl4+(2+x)H2O
2TiCl4+2FeCl3+6CO ����������FeCl3���壬��ȥFeCl3 ȱ������CO��ֹ��Ⱦ������װ�� TiCl4+(2+x)H2O![]() TiO2xH2O+4HCl
TiO2xH2O+4HCl
��������
Ũ������KMnO4��Ӧ��ȡCl2������Ũ������лӷ��ԣ���ȡ�õ���Cl2�к�������HCl��ˮ�������ñ���NaCl��Һ��ȥHCl��Ȼ��Ũ�������õ�����Cl2����A����������̿�ڼ���ʱ������Ӧ����TiCl4��FeCl3��ˮ����Bװ���п����¶���150��200�棬��FeCl3���������ȥ��C�ռ���Ʒ��Dװ���ü�ʯ�����շ�Ӧ��ʣ���������ͬʱ��ֹ�����е�ˮ��������Cװ�ã�����װ��ȱ�ٶ�CO������װ�á�
(1)����aΪ���������ܣ�װ����װ���Ժ����Լ�֮ǰ����еIJ����Ǽ��װ�õ������ԣ�
(2)ʵ�����Ƚ���������飬�����Թ�����̿�ۻ�Ͼ��ȣ��Ƴɶ��״�������������Ӧ��Ӵ��棬̿���Թ�����������������������ʣ�
(3)ʵ��������ͨ��N2����һ��ͨ�����ų�װ���еĿ�������ֹ�����ʵ�飬�ڶ���ͨ��N2�������ǽ����ɵ�TiCl4������ȫ������������ȴ��
(4)���﴿����������A����FeTiO3��̿�۵Ļ���ﷴӦ�������Ȼ��Ѻ��Ȼ������仯ѧ��Ӧ����ʽΪ��2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO��
2TiCl4+2FeCl3+6CO��
(5)��Ϊ��Ӧ�������Ȼ��Ѻ��Ȼ����������Ȼ��ѳ�����ΪҺ�壬�е�136.4�棬�Ȼ������۵�306�棬�е�315�棬װ��B�Ŀ������¶���150��200�棬�Ϳ���ʹ�Ȼ�������Ϊ���壬�Ӷ������ý����ɵ�TiCl4������ȫ������������ȴ���������Ȼ������룻
(6)Dװ���ü�ʯ�����շ�Ӧ��ʣ���������ͬʱ��ֹ�����е�ˮ��������Cװ�ã�����װ��ȱ�ٶ�CO������װ�ã�
(7) ����TiCl4���ȳ�ʪ�����С����̡�����TiO2xH2O����Ӧ�Ļ�ѧ����ʽΪTiCl4+(x+2)H2O![]() TiO2xH2O��+4HCl��
TiO2xH2O��+4HCl��

����Ŀ�������£�������ĵ���ƽ�ⳣ�����£�
��ѧʽ | HF | HCN | H2CO3 |
���볣�� | Ka��3.5��10��4 | Ka��5.0��10��10 | Ka1��4.3��10��7�� Ka2��5.6��10��11 |
��1��c(H+)��ͬ�������ᣬ�����Ũ�ȴӴ�СΪ________________��
��2��0.0lmol/L��HCN��Һ�У�c(H+)ԼΪ_____mol/L��ʹ����Һ��HCN�ĵ���̶�������c(H+)Ҳ����ķ�����_______________________��
��3���к͵�����NaOH�����ĵ�pH�����������������ֱ�ΪaL��bL����a_____b������ڡ�����С�ڡ����ڡ�����ͬ��b���к͵�Ũ�ȡ��������������������ҪNaOH�����ʵ���Ϊn1��n2����n1_____n2��
��4����NaCN��ͨ��������CO2�����������ӷ���ʽΪ_______________��
��5�����ʵ��֤�������������������__________________��