题目内容
20.四种短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z左右相邻,Z、W位于同一主族;Z、W两原子的核外电子数之和为X、Y两原子核外电子电子数之和的三倍.(1)Y元素是氮(填元素名称);W在元素周期表中的位置是第三周期第ⅥA族.
(2)由X、Y、Z三种元素组成的盐中存在的化学键是离子键、共价键;X分别与Y、Z和W组成的最简单化合物中,最稳定的是H2O(填化学式).
(3)由上述四种元素组成的化合物A既能与强碱反应,又能与强酸反应,又知化合物A中Y 的质量分数约为24.14%.A的化学式为(NH4)2SO3;将A与足量的NaOH溶液混合并加热,写出该反应的化学方程式:(NH4)2SO3+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO3+2NH3↑+2H2O.
分析 四种短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z左右相邻,Z、W位于同一主族,设Y的原子序数为a,则Z、W原子序数分别为a+1、a+9,令X的原子序数为b,Z、W两原子的核外电子数之和为X、Y两原子核外电子电子数之和的三倍,则a+1+a+9=3(a+b),整理得10=a+3b,由于a>b,故b只能为1,则a=7,故X为H元素、Y为N元素、Z为O元素、W为S元素,据此解答.
解答 解:四种短周期主族元素X、Y、Z、W的原子序数依次增大,其中Y、Z左右相邻,Z、W位于同一主族,设Y的原子序数为a,则Z、W原子序数分别为a+1、a+9,令X的原子序数为b,Z、W两原子的核外电子数之和为X、Y两原子核外电子电子数之和的三倍,则a+1+a+9=3(a+b),整理得10=a+3b,由于a>b,故b只能为1,则a=7,故X为H元素、Y为N元素、Z为O元素、W为S元素.
(1)由上述分析可知,Y为氮元素,W为S元素,在元素周期表中的位置是:第三周期第ⅥA族,
故答案为:氮;第三周期第ⅥA族;
(2)由H、N、O三种元素组成的盐为硝酸铵,含有离子键、共价键;
由于非金属性O>N,O>S,故简单氢化物中,最稳定的是H2O,
故答案为:离子键、共价键;H2O;
(3)由上述四种元素组成的化合物A既能与强碱反应,又能与强酸反应,属于弱酸形成的铵盐,应是亚硫酸与氨气形成的盐,化合物中N元素的质量分数约为24.14%,A的化学式为(NH4)2SO3,将A与足量的NaOH溶液混合并加热,该反应的化学方程式:(NH4)2SO3+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO3+2NH3↑+2H2O,
故答案为:(NH4)2SO3;(NH4)2SO3+2NaOH$\frac{\underline{\;\;△\;\;}}{\;}$Na2SO3+2NH3↑+2H2O.
点评 本题考查结构与位置性质关系的利用,推断元素是解题关键,侧重考查学生分析推理能力,难度中等.

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案| A. | 次氯酸钙的化学式:CaClO | |
| B. | 氟离子结构示意图: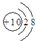 | |
| C. | 质量数为137的钡原子:${\;}_{137}^{56}$Ba | |
| D. | 硫酸的电离方程式:H2SO4=2H++SO42- |
| A. | 按系统命名法: 的名称为3,3,6三甲基4乙基庚烷 的名称为3,3,6三甲基4乙基庚烷 | |
| B. | 如图是某有机物分子的比例模型,该物质可能是一种氨基酸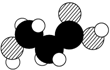 | |
| C. | 能用新制氢氧化铜和NaOH溶液鉴别甘油、葡萄糖溶液、乙酸钠溶液 | |
| D. | 木糖醇( 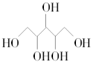 )和葡萄糖( )和葡萄糖(  )互为同系物,均属于糖类 )互为同系物,均属于糖类 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | CH4+Cl2→CH3Cl+HCl | B. | CH2=CH2+H2O→CH3CH2OH | ||
| C. |  +HO-NO2→ +HO-NO2→ +H2O +H2O | D. | CH3CH2OH→CH2=CH2+H2O |
| A. | 将等物质的量的CH4和Cl2在光照下反应生成纯净的CH3Cl | |
| B. | 将苯与浓硝酸和浓硫酸混合水浴加热制取硝基苯 | |
| C. | 用新制Cu(OH)2悬浊液鉴别葡萄糖和蔗糖 | |
| D. | 用浓硝酸鉴别淀粉溶液和鸡蛋白溶液 |
 ,而不排布成
,而不排布成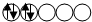 ,其直接的根据是洪特规则.
,其直接的根据是洪特规则.
 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$ +H2O
+H2O
 .
.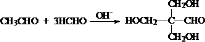 .
.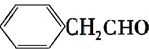
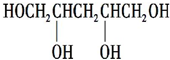 .
.