题目内容
【题目】某化学兴趣小组欲用下列装置制备氯水并探究其性质。
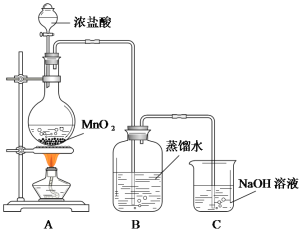
已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)C装置的作用是__________________________________。
(2)氯水制备完成后,甲同学从B中取出一定量的样品置于日光下照射一段时间,发现样品某些性质发生了明显的变化,请各列举一项:
物理性质变化:______________________________________________________;
化学性质变化:_______________________________________________________。
(3)乙同学从B中取出一定量的样品后通入SO2,充分作用后再滴入少量品红溶液,发现品红溶液不褪色。原因是__________________________________(用离子方程式表示)。丙同学改变通入SO2的量,重复乙同学的操作,发现品红溶液红色褪去。他提出:假设①:SO2过量,多余的SO2使品红溶液褪色;假设②:_________________________。请设计实验验证假设①是否成立:______________________。
(4)为证明氯气与水反应产物具有漂白性,丁同学将A中产生的气体缓缓通过下列装置:

试剂a应选择_______________;试剂b应选择_______________。
(5)戊同学从B中取出少量样品,滴到NaHCO3粉末上,有无色气泡产生,由此他认为氯气与水反应至少产生一种酸性强于碳酸的物质。请评价他的观点是否正确并说明理由________。
【答案】吸收多余氯气 溶液颜色变浅 溶液酸性增强(或漂白性减弱等) SO2 + Cl2 + 2H2O =4H+ +SO42- + 2Cl— SO2少量,多余的Cl2使品红溶液褪色 加热该溶液,若溶液恢复成红色,则假设①成立 CaCl2 碱石灰 不正确,因为A中会挥发出HCl进入B中,使溶液中存在盐酸
【解析】
(1)C装置的作用是尾气处理,吸收多余氯气。
(2)次氯酸见光分解2HClO![]() 2HCl+O2↑,Cl2+H2O
2HCl+O2↑,Cl2+H2O![]() HCl+HClO平衡向右移动。
HCl+HClO平衡向右移动。
(3)SO2和Cl2发生氧化还原反应生成盐酸和硫酸,SO2 + Cl2 + 2H2O =4H+ +SO42- + 2Cl—。
(4)试剂a是干燥氯气的,氯气和氯化钙不反应,可以用CaCl2,球形干燥管是吸收多余氯气的,防止污染空气,故用碱石灰。
(5)因为浓盐酸具有挥发性,会挥发出HCl进入B中,使溶液中存在盐酸,故评价不正确。
(1)C装置的作用是尾气处理,吸收多余氯气,故答案为:吸收多余氯气。
(2)氯水制备完成后,甲同学从B中取出一定量的样品置于日光下照射一段时间,次氯酸见光分解2HClO![]() 2HCl+O2↑,Cl2+H2O
2HCl+O2↑,Cl2+H2O![]() HCl+HClO平衡向右移动,溶液颜色变浅,次氯酸是弱酸,分解生成盐酸,盐酸是强酸,所以溶液酸性增强(或漂白性减弱),故答案为:溶液颜色变浅 ;溶液酸性增强(或漂白性减弱等)。
HCl+HClO平衡向右移动,溶液颜色变浅,次氯酸是弱酸,分解生成盐酸,盐酸是强酸,所以溶液酸性增强(或漂白性减弱),故答案为:溶液颜色变浅 ;溶液酸性增强(或漂白性减弱等)。
(3)SO2和Cl2发生氧化还原反应生成盐酸和硫酸,SO2 + Cl2 + 2H2O =4H+ +SO42- + 2Cl—,
假设①:SO2过量,多余的SO2使品红溶液褪色;因为SO2和氯水都能漂白品红,假设②:SO2少量,多余的Cl2使品红溶液褪色;SO2的漂白性只是暂时的,没有持久性,为了验证假设①是否成立,可以加热该溶液,若溶液恢复成红色,则假设①成立,故答案为:SO2 + Cl2 + 2H2O =4H+ +SO42- + 2Cl—;SO2少量,多余的Cl2使品红溶液褪色;加热该溶液,若溶液恢复成红色,则假设①成立。
(4)试剂a是干燥氯气的,氯气和氯化钙不反应,可以用CaCl2,球形干燥管是吸收多余氯气的,防止污染空气,故用碱石灰,故答案为:CaCl2;碱石灰。
(5)因为浓盐酸具有挥发性,会挥发出HCl进入B中,使溶液中存在盐酸,故评价不正确,故答案为:不正确,因为A中会挥发出HCl进入B中,使溶液中存在盐酸。

【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。