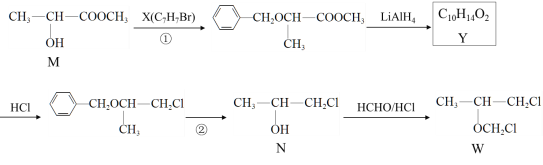
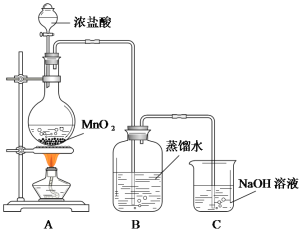
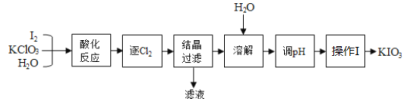
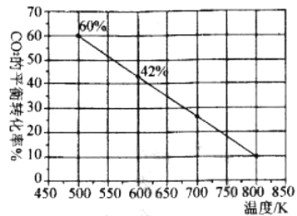
题目内容
【题目】Na2SO3是常见的一种盐,工业上可作防腐剂、去氯剂和还原剂。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-。反应的化学方程式为________________;若有0.5molNa2SO3参加反应,则电子转移个数为_____________________。
(2)将0.1mol/L Na2SO3溶液先升温再降温,测定温度变化过程中的pH,数据如下:
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
①时刻Na2SO3溶液中水的电离程度_______同温下纯水中水的电离程度(填)“>”、“<”或“=”);应用平衡原理解释该原因_________________________________。④的pH略小于①,是由于______________________。设计一个简单实验来证明_____________________。
(3)将Na2SO3溶液中所有离子浓度由大到小排列_________________________________。
【答案】4Na2SO3![]() Na2S+3Na2SO4 0.75NA > 水存在电离平衡:H2O
Na2S+3Na2SO4 0.75NA > 水存在电离平衡:H2O![]() H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动。 Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4 取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动。 Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4 取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)
【解析】
(1)Na2SO3固体隔绝空气加强热,硫元素发生歧化反应,据此写出方程式,并根据反应6e-~4Na2SO3关系,计算0.5molNa2SO3参加反应,电子转移个数;
(2)能水解的盐促进水的电离;亚硫酸钠具有还原性,能够被氧气氧化为硫酸钠,硫酸钠不水解,显中性,据此进行分析;根据硫酸根离子的检验方法判断亚硫酸钠中是否含有硫酸钠;
(3) Na2SO3溶液中存在水解平衡:SO32-+H2O ![]() HSO3- +OH- ,HSO3- + H2O
HSO3- +OH- ,HSO3- + H2O ![]() H2SO3 +OH- ,据此分析离子浓度大小顺序。
H2SO3 +OH- ,据此分析离子浓度大小顺序。
(1)Na2SO3固体隔绝空气加强热,反应后的固体中含有S2-,说明部分硫元素发生还原反应生成S2-,还有部分硫元素发生氧化反应生成SO42-,因此反应的化学方程式为4Na2SO3![]() Na2S+3Na2SO4;该反应转移电子为6e-;根据6e-~4Na2SO3关系可知,若有0.5molNa2SO3参加反应,则电子转移个数为0.75 NA;
Na2S+3Na2SO4;该反应转移电子为6e-;根据6e-~4Na2SO3关系可知,若有0.5molNa2SO3参加反应,则电子转移个数为0.75 NA;
综上所述,本题答案是:4Na2SO3![]() Na2S+3Na2SO4 ; 0.75NA。
Na2S+3Na2SO4 ; 0.75NA。
(2) 水存在电离平衡:H2O![]() H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动。促进了水的电离,所以Na2SO3溶液中水的电离程度大于同温下纯水中水的电离程度;亚硫酸钠的还原性比较强,随着温度的变化,或有Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4,所以④的pH略小于①;要证明此实验事实的存在,就是要证明溶液中是否含有硫酸离子,可以用过量的盐酸和氯化钡溶液进行检验,具体操作如下:取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 ;
H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动。促进了水的电离,所以Na2SO3溶液中水的电离程度大于同温下纯水中水的电离程度;亚硫酸钠的还原性比较强,随着温度的变化,或有Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4,所以④的pH略小于①;要证明此实验事实的存在,就是要证明溶液中是否含有硫酸离子,可以用过量的盐酸和氯化钡溶液进行检验,具体操作如下:取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 ;
综上所述,本题答案是:>;水存在电离平衡:H2O![]() H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动;Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4 ; 取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 。
H++OH-,SO32-与H+结合生成HSO3-、H2SO3,降低了H+浓度,使水的电离平衡向右移动;Na2SO3部分被氧化成硫酸钠2Na2SO3+O2=2Na2SO4 ; 取④的溶液少许于试管中,先滴入足量稀盐酸,再滴入BaCl2溶液,若有白色沉淀生成,则证明有Na2SO3被氧化成Na2SO4 。
(3) Na2SO3溶液中存在水解平:SO32-+H2O ![]() HSO3- +OH- ,HSO3- + H2O
HSO3- +OH- ,HSO3- + H2O ![]() H2SO3 +OH- ,溶液显碱性,从水解的规律可知Na2SO3溶液中所有离子浓度由大到小排列:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
H2SO3 +OH- ,溶液显碱性,从水解的规律可知Na2SO3溶液中所有离子浓度由大到小排列:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+);
综上所述,本题答案是:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+)。

 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案