题目内容
【题目】合成尿素的反应为:2NH3 (g) +CO2 (g)CO(NH2)2(s) +H2O (g) +Q(Q>0)一定条件下,在10 L的恒容密闭容器中,充入2molNH3和1molCO2。反应经5min后达到平衡,测得容器中的浓度为0.05mol/L。完成下列填空:
(1)平均反应速率v(NH3)=_____________。
(2)下列描述中能说明上述反应已达平衡的是__________(填序号)。
a.2v正(NH3)=v逆(H2O) b.气体的平均相对分子质量不随时间而变化
c. NH3和CO2的比例保持不变 d.气体的压强不再发生变化
(3)为提高尿素的产率,工业上用该反应生产要素时,合适的反应条件是_______。(填序号)
a.200℃ b.800℃ c.101kPa d.24000kPa
【答案】0.02mol/(L·min) bd ad
【解析】
(1)根据已知信息,计算平衡时氨气的转化量,再根据公式![]() 计算速率;
计算速率;
(2)根据化学平衡状态的特征判断,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态;
(3)根据影响平衡移动的因素进行分析。
(1)一定条件下,在10L的恒容密闭容器中,充入2mol NH3和1mol CO2,反应经5min后达到平衡,测得容器中CO2的浓度为0.05mol·L-1,则消耗0.5molCO2、1molNH3,则氨气的反应速率为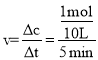 =0.02mol/(L·min),故答案为:0.02mol/(L·min);
=0.02mol/(L·min),故答案为:0.02mol/(L·min);
(2) a.2υ正(NH3)=υ逆(H2O),正逆反应速率不等,没有达到平衡状态,a项错误;
b.反应前后气体的物质的量不等,气体的平均相对分子质量不随时间而变化,可说明达到平衡状态,b项正确;
c.充入2mol NH3和1mol CO2,且按2:1反应,则无论是否达到平衡状态,NH3和CO2的比例都保持不变,c项错误;
d.反应前后气体体积不等,则气体的压强不再发生变化,可说明达到平衡状态,d项正确;故答案为:bd;
(3)为提高氨气的转化率,采用使得化学平衡正向移动的措施即可,正反应为放热反应,体积减小,工业上用该反应生产尿素时,合适的反应条件是低温高压,故选:ad。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
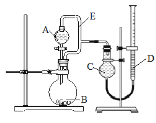
小学生10分钟应用题系列答案【题目】用如图所示装置分别进行实验,请回答下列问题:
实验 | A中试剂 | B中试剂 | C中液体 |
I | 饱和食盐水 | 电石 | H2O |
II | 浓氨水 | NaOH固体 | CCl4 |
III | 生铁 | H2O | |
IV | NaOH溶液 | 镁铝合金 | H2O |
(1)导管E的作用是:____________________、_________________;
(2)实验I烧瓶B中发生反应的化学方程式是________,产生的气体经验纯后点燃,现象是___________;
(3)实验Ⅱ剩余的NH3需吸收处理。以下各种尾气吸收装置中,不能防止倒吸的是___________;

(4)实验III的实验目的是验证生铁在潮湿空气中会发生吸氧腐蚀。则A中试剂可选用__________(填序号);
a NaOH溶液 b C2H5OH c NaCl溶液 d 稀硫酸
能证明生铁在潮湿空气中会发生吸氧腐蚀的现象是_________;
(5)写出实验IV中发生反应的离子方程式_________;若读数时C管液面低于D管液面,则测出的镁铝合金中镁的质量分数将_______(填“偏高”、“偏低”或“无影响”)。
【题目】I. 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色液体,易溶于水。为研究A 的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
①称取9.0gA,升温使其气化,测其密度是相同条件下H2的45 倍 | 试通过计算填空:(1)A的相对分子质量为________ |
②将此9.0gA在足量纯O2中充分 燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g | (2)A的分子式为________ |
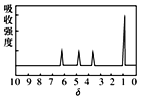
③又知A含有官能团—COOH、—OH,且A的核磁共振氢谱如图: |
|
(3)综上所述,A的结构简式为________ | |
II. 工业上常以A物质为原料合成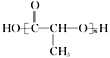 ,该反应类型属于______(填字母代号,下同)反应。
,该反应类型属于______(填字母代号,下同)反应。
A 加聚 B 缩聚
III. 下列关于物质的分离、提纯实验中的一些操作或做法,正确的是_______。
A 在组装蒸骝装置时,温度计的水银球应伸入液面下
B 用96%的工业酒精制取无水乙醇时,先加入无水CuSO4,再过滤
C 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加入少量蒸馏水
D 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温再过滤