题目内容
已知:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
请回答下列问题:
(1)上述反应的化学平衡常数表达式为 ,该反应的Q 0。
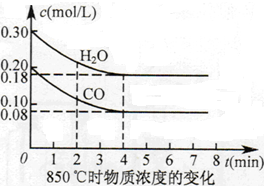
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反应速率v(CO)= 。
(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020mol/L,该条件下,CO的最大转化率为 。
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x平衡时CO的转化率为y,试推导y随x变化的函数关系式为 。
(5)某电化学装置可实现2CO2=2CO+O2的转化,使CO重复使用。已知该反应的阳极应为4OH--4e-=2H2O+O2,则阴极反应式为 。
(6)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染,请判断上述反应能否发生 (填“可能”或“不可能”),理由是 。
 CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
(1)上述反应的化学平衡常数表达式为 ,该反应的Q 0。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)浓度变化如图所示,则0~4min时平均反应速率v(CO)= 。

(3)若在500 ℃时进行,且CO、H2O(g)的起始浓度均为0.020mol/L,该条件下,CO的最大转化率为 。
(4)若在850℃时进行,设起始时CO和H2O(g)共为1mol,其中水蒸气的体积分数为x平衡时CO的转化率为y,试推导y随x变化的函数关系式为 。
(5)某电化学装置可实现2CO2=2CO+O2的转化,使CO重复使用。已知该反应的阳极应为4OH--4e-=2H2O+O2,则阴极反应式为 。
(6)有人提出可以设计反应2CO=2C+O2(ΔH>0)来消除CO的污染,请判断上述反应能否发生 (填“可能”或“不可能”),理由是 。
(1)K=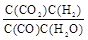 <
<
(2)0.03 mol/(L·min)
(3)75%
(4)y=x
(5)CO2+2e-+H2O=CO+2OH-
(6)不可能;ΔH>0吸热且ΔS<0 或依据吉布斯自由能判断反应不能自发进行
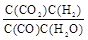 <
< (2)0.03 mol/(L·min)
(3)75%
(4)y=x
(5)CO2+2e-+H2O=CO+2OH-
(6)不可能;ΔH>0吸热且ΔS<0 或依据吉布斯自由能判断反应不能自发进行
(1)根据平衡常数的定义可得K=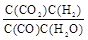 ,随温度升高,平衡常数减小,说明升温平衡向逆移动,正反应是放热反应,Q <0。
,随温度升高,平衡常数减小,说明升温平衡向逆移动,正反应是放热反应,Q <0。
(2)0—4min时,CO的浓度减少0.12mol/L,所以v(CO)="0.03" mol/(L·min) 。
(3)500 ℃时,K=9,设CO的浓度减少xmol/L,则有9(0.02-x)2=x2,x=0.015mol/L,该条件下,CO最大的转化率为75%。
(4))850 ℃时,K=1,起始时CO和H2O共为1mol,其中水蒸气的体积分数是x,所以H2O(g)的物质的是为xmol,CO的物质的量为(1-x)mol,设平衡时CO转化了amol,则a2=(x-a)(1-x-a),解得a=x-x2,CO的转化率为(x-x2)/(1-x)=x;
(5)总的是2CO2=2CO+O2,阳极反应为4OH—4e-=2H2O+O2,则总反应减去阳极得到阴极反应式为,CO2+2e-+H2O=CO+2OH- 。
(6)不可能,因为该反应属于熵减焓增的反应,不能自发进行。
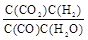 ,随温度升高,平衡常数减小,说明升温平衡向逆移动,正反应是放热反应,Q <0。
,随温度升高,平衡常数减小,说明升温平衡向逆移动,正反应是放热反应,Q <0。(2)0—4min时,CO的浓度减少0.12mol/L,所以v(CO)="0.03" mol/(L·min) 。
(3)500 ℃时,K=9,设CO的浓度减少xmol/L,则有9(0.02-x)2=x2,x=0.015mol/L,该条件下,CO最大的转化率为75%。
(4))850 ℃时,K=1,起始时CO和H2O共为1mol,其中水蒸气的体积分数是x,所以H2O(g)的物质的是为xmol,CO的物质的量为(1-x)mol,设平衡时CO转化了amol,则a2=(x-a)(1-x-a),解得a=x-x2,CO的转化率为(x-x2)/(1-x)=x;
(5)总的是2CO2=2CO+O2,阳极反应为4OH—4e-=2H2O+O2,则总反应减去阳极得到阴极反应式为,CO2+2e-+H2O=CO+2OH- 。
(6)不可能,因为该反应属于熵减焓增的反应,不能自发进行。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g), n(H2)随时间(t)的变化如图所示: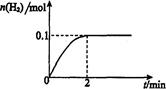
 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是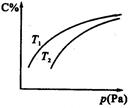
 4NO(g)+6H2O(g)ΔH=-a kJ·mol-1
4NO(g)+6H2O(g)ΔH=-a kJ·mol-1 4NO2(g)+O2(g) ΔH=+d kJ·mol-1
4NO2(g)+O2(g) ΔH=+d kJ·mol-1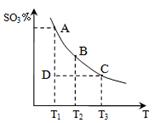
 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”、“向右”或“不移动”); 2CO2+N2。它的优点是 ;
2CO2+N2。它的优点是 ;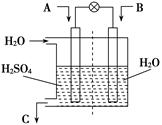
 CO2(g)+H2(g),有如下数据:
CO2(g)+H2(g),有如下数据: 4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0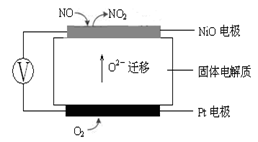
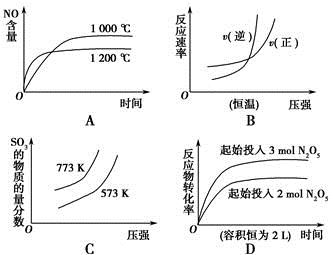
 2NH3(g) ΔH<0。下列研究目的和图示相符的是
2NH3(g) ΔH<0。下列研究目的和图示相符的是