题目内容
(2014届浙江省嘉兴市高三教学测试(二)理综化学试卷)
汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
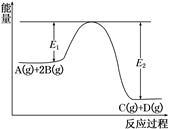
①CH4(g)+4NO2(g)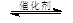 4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0
②CH4(g)+4NO(g)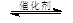 2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0
③CH4(g) +2NO2(g)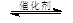 N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
①写出该反应平衡常数的表达式K= 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则K将 。(填“增大”、“减小”或“不变”。)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1
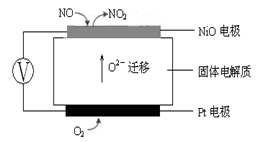
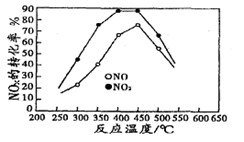
图1 图2
①NiO电极上NO发生的电极反应式: 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO)︰V(NO2)=
(4)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
E.增加原催化剂的表面积 F.减小投料比[n(NO2) / n(CH4)]
汽车尾气中的NOx是大气污染物之一,科学家们在尝试用更科学的方法将NOx转化成无毒物质,从而减少汽车尾气污染。
(1)压缩天然气(CNG)汽车的优点之一是利用催化技术能够将NOx转变成无毒的CO2和N2。
①CH4(g)+4NO2(g)
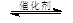 4NO(g)+CO2(g)+2H2O(g) △H1<0
4NO(g)+CO2(g)+2H2O(g) △H1<0②CH4(g)+4NO(g)
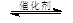 2N2(g)+CO2(g)+2H2O(g) △H2<0
2N2(g)+CO2(g)+2H2O(g) △H2<0③CH4(g) +2NO2(g)
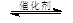 N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)
N2(g) +CO2(g) +2H2O(g) △H3= 。(用△H1和△H2表示)(2)在恒压下,将CH4(g)和NO2(g)置于密闭容器中发生化学反应③,在不同温度、不同投料比时,NO2的平衡转化率见下表:
| 投料比[n(NO2) / n(CH4)] | 400 K | 500 K | 600 K |
| 1 | 60% | 43% | 28% |
| 2 | 45% | 33% | 20% |
①写出该反应平衡常数的表达式K= 。
②若温度不变,提高[n(NO2) / n(CH4)]投料比,则K将 。(填“增大”、“减小”或“不变”。)
③400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数 。
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪的工作原理示意图如图1


图1 图2
①NiO电极上NO发生的电极反应式: 。
②收集某汽车尾气经测量NOx的含量为1.12%(体积分数),若用甲烷将其完全转化为无害气体,处理1×104L(标准状况下)该尾气需要甲烷30g,则尾气中V(NO)︰V(NO2)=
(4)在容积相同的两个密闭容器内 (装有等量的某种催化剂) 先各通入等量的CH4,然后再分别充入等量的NO和NO2。在不同温度下,同时分别发生②③两个反应:并在t秒时测定其中NOx转化率,绘得图象如图2所示:
①从图中可以得出的结论是
结论一:相同温度下NO转化效率比NO2的低
结论二:在250℃-450℃时,NOx转化率随温度升高而增大,450℃-600℃时NOx转化率随温度升高而减小
结论二的原因是
②在上述NO2和CH4反应中,提高NO2转化率的措施有_________。(填编号)
A.改用高效催化剂 B.降低温度 C.分离出H2O(g) D.增大压强
E.增加原催化剂的表面积 F.减小投料比[n(NO2) / n(CH4)]
(1) (1分)
(1分)
(2)① (1分) 不变 (2分)
(1分) 不变 (2分)
② 17.4% (2分)
(3)① NO+ O2 --2e- = NO2 (2分)
② 1 : 1 (2分)
(4)① 原因是:在250℃-450℃时,反应未达到平衡,反应还在正向进行。 (1分)
450℃-600℃时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高而减小。(其他合理答案也给分) (1分)
② BCF (2分)
 (1分)
(1分)(2)①
 (1分) 不变 (2分)
(1分) 不变 (2分)② 17.4% (2分)
(3)① NO+ O2 --2e- = NO2 (2分)
② 1 : 1 (2分)
(4)① 原因是:在250℃-450℃时,反应未达到平衡,反应还在正向进行。 (1分)
450℃-600℃时,反应已达平衡,所以,温度升高平衡逆向移动,NOx转化率随温度升高而减小。(其他合理答案也给分) (1分)
② BCF (2分)
(1)
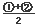 即为目标方程式③,所以,
即为目标方程式③,所以,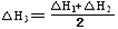
(2)① 该反应的平衡常数的表达式
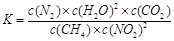
② 平衡常数K不受浓度和压强的影响,只受温度的影响,温度不变K不变。
③ 400 K时,将投料比为1的NO2和CH4的混合气体共0.04 mol,充入一装有催化剂的容器中,充分反应后,平衡时NO2的体积分数为:
CH4(g) + 2NO2(g)
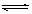 N2(g) + CO2(g) + 2H2O(g)
N2(g) + CO2(g) + 2H2O(g)n始 0.02 0.02 0 0 0
n转 0.006 0.02×0.6=0.012 0.006 0.006 0.012
n平 0.014 0.008 0.006 0.006 0.012
0.014 + 0.008 + 0.006 + 0.006 + 0.012 = 0.046
平衡时NO2的体积分数=
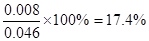
(3)连续自动监测氮氧化物(NOx)的仪器动态库仑仪实际上就是应用原电池原理,从图1可知Pt电极(通入O2的一极)为电池的正极,NiO电极(通入NO的一极)为电池的负极,O2 –可以通过固体电解质移向负极。所以,
① NiO电极上NO发生的电极反应式:NO+ O2 --2e- = NO2。
②1×104L(标准状况下)尾气中含NOx的体积为:1×104L×1.12% = 112L,
NOx的物质的量为:
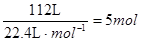 。
。设NO和NO2的物质的量分别为x、y mol,根据反应化学方程式①和②:
① CH4(g) + 4NO2(g)
 4NO(g) + CO2(g)+2H2O(g)
4NO(g) + CO2(g)+2H2O(g) 16g 4 4
m 1 y y m 1 = 4y
② CH4(g) + 4NO(g)
 2N2(g) + CO2(g)+2H2O(g)
2N2(g) + CO2(g)+2H2O(g) 16g 4
m 2 (x+y) m 2 = 4(x+y)
则: x+y = 5;4(x+y)+ 4y = 30
解得:x ="2.5" mol =" 2.5" mol
所以,尾气中V(NO)︰V(NO2) =" 1" ︰ 1 。
(4)①从图2 变化曲线分析,结论二的原因是:在250℃-450℃时,反应未达到平衡,反应还在正向进行;故NOx转化率随温度升高而增大;在在450℃-600℃时反应已达到平衡状态,因为该反应是放热反应,此时温度升高平衡逆向移动,故 NOx转化率随温度升高而减小。
② 由上述NO2和CH4反应的化学方程式的特点分析可知: 该反应是放热反应;该反应是扩大气体体积的反应。所以要提高NO2转化率,可降低温度,降低温度能使平衡正向移动,从而提高NO2转化率;分离出H2O,相当于减小生成物的浓度,使平衡正向移动,从而提高NO2转化率;减小投料比[n(NO2) / n(CH4)],相当于增加反应物CH4的浓度,使平衡正向移动,从而增大NO2转化率。而使用催化剂只能改变反应速率,不影响平衡移动,故NO2转化率不会变化。增大压强,平衡逆移,NO2转化率会减小。因此选B C F。

练习册系列答案
相关题目
 2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。
2(t-BuNO) 。该温度下该反应在CCl4溶剂中的平衡常数为1.4。 
 CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH=Q,其平衡常数随温度变化如下表所示: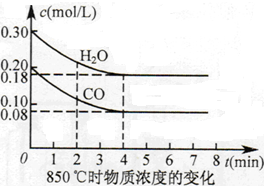
 2HI(g)在密闭容器中反应,达到平衡状态时的标志是( )
2HI(g)在密闭容器中反应,达到平衡状态时的标志是( ) 
 cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是 4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是
4Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),平衡时X、Y、Z的浓度分别为0.2mol·L-1、0.3 mol·L-1、0.16 mol·L-1,则下列判断不合理的是