题目内容
11.已知在密闭容器中发生的反应:H2(g)+I2(g)?2HI(g)△H<0.若改变下列条件,则其反应速率发生的变化是(在表格的相应空格内填“√”)| 序号 | 改变条件 | 反应速率变化 | ||
| 增大 | 减小 | 不变 | ||
| (1) | 升高温度 | |||
| (2) | 充入更多的H2 | |||
| (3) | 扩大容器的体积 | |||
| (4) | 定容充入氦气 | |||
分析 (1)升高温度,正逆反应速率均增大;
(2)增大反应物浓度,正逆反应速率均增大;
(3)扩大容器的体积,相当于减小压强,正逆反应速率均减小;
(4)定容充入氦气,反应体系中各物质的浓度不变,则反应速率不变.
解答 解:(1)升高温度,正逆反应速率均增大,则反应速率增大;
(2)充入更多的H2,是增大反应物浓度,正逆反应速率均增大,则反应速率增大;
(3)扩大容器的体积,相当于减小压强,正逆反应速率均减小,则反应速率减小;
(4)定容充入氦气,反应体系中各物质的浓度不变,则反应速率不变,
故答案为:
| 序号 | 改变条件 | 反应速率变化 | ||
| 增大 | 减小 | 不变 | ||
| (1) | √ | |||
| (2) | √ | |||
| (3) | √ | |||
| (4) | √ | |||
点评 本题考查影响化学反应速率的因素,为高频考点,把握常见的外界因素对化学反应速率的影响为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
1.某无色溶液中加入铝片可以生成氢气,则该溶液中一定能大量共存的离子组是( )
| A. | K+、Cu2+、NO3-、Cl- | B. | K+、Na+、SO42-、Cl- | ||
| C. | K+、NH4+、HCO3-、Cl- | D. | K+、Mg2+、NO3-、Cl- |
16.下列化学用语表示正确的是( )
| A. | 氯化氢的电子式: | |
| B. | 乙烷的结构简式:C2H6 | |
| C. | 铝的原子结构示意图: | |
| D. | 硫酸钠的电离方程式:Na2SO4=2Na++$S{{O}_{4}}^{2-}$ |
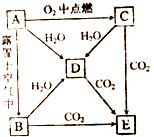 A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题:
A、B、C、D、E五中物质中都含有钠元素,其互相转化关系如题: .
. 原电池是将化学能转变成电能的装置.某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示:
原电池是将化学能转变成电能的装置.某铜锌稀硫酸原电池中,电子由A极流出经导线流入B极,如图所示: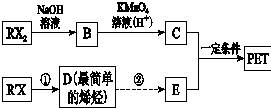 PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2是芳香族化合物(R、R′代表烃基,X代表卤素原子),相对分子质量为175,其中X元素的质量分数为40.6%.
PET是聚酯类合成材料,以卤代烃为原料合成PET的线路如图(反应中部分无机反应物及产物已省略).已知RX2是芳香族化合物(R、R′代表烃基,X代表卤素原子),相对分子质量为175,其中X元素的质量分数为40.6%. .
.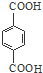 +nHOCH2CH2OH$\stackrel{一定条件下}{→}$
+nHOCH2CH2OH$\stackrel{一定条件下}{→}$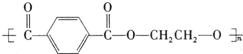 +2nH2O.
+2nH2O. .
.