题目内容
7.为测定某卤代烃的组成,某同学设计实验如下:①量取该卤代烃液体11.4mL,加入适量NaOH溶液,加热反应至液体不分层;②冷却后用稀硝酸酸化,再加入过量硝酸银;③过滤沉淀,洗涤沉淀2~3次;④将沉淀干燥后称重.回答下列问题:
(1)①中加入NaOH的目的是中和卤代烃水解产生的卤化氢,使水解完全.
(2)②中加入过量硝酸银的目的是使卤离子沉淀完全.
(3)若②中生成的沉淀为淡黄色,则该卤代烃中的卤原子是Br.
(4)若称得沉淀的质量为37.6g,又测得卤代烃的密度为1.65g•mL-1,其蒸气密度是相同条件下氢气密度的94倍.则该卤代烃分子中含有2个卤原子.
(5)写出该卤代烃可能的结构简式CH2BrCH2Br、CH3CHBr2.
分析 卤代烃在碱性条件下水解,当加热反应至液体不分层时,说明卤代烃完全水解生成卤素离子和醇,冷却后加入硝酸酸化并加入过量硝酸银,可保证完全生成沉淀,将沉淀洗涤、干燥,因沉淀颜色为淡黄色,可知生成AgBr,根据n=$\frac{m}{M}$计算AgBr的物质的量,该有机物的蒸气密度是相同条件下氢气密度的94倍,求出其相对分子质量,根据m=ρV计算该有机物的质量,再根据n=$\frac{m}{M}$求出卤代烃的物质的量,确定卤代烃中的卤原子数目,以此解答该题.
解答 解:(1)卤代烃在碱性条件下完全水解,所以加入NaOH的目的是中和卤代烃水解产生的卤化氢,使水解完全,故答案为:中和卤代烃水解产生的卤化氢,使水解完全;
(2)加入过量的硝酸银的目的是将所有的卤素原子完全转化成沉淀,使测量结果更准确,
故答案为:使卤离子沉淀完全;
(3)若②中生成的沉淀为淡黄色,则该沉淀为AgBr,所以该卤代烃中的卤原子是Br,故答案为:Br;
(4)若称得沉淀的质量为37.6g,n(AgBr)=$\frac{m}{M}$=$\frac{37.6g}{188g/mol}$=0.2mol;
已知该有机物的蒸气密度是相同条件下氢气密度的94倍,则其相对分子质量为188,m=ρV=1.65g•mL-1×11.4mL=18.8g,该有机物的物质的量n=$\frac{m}{M}$=$\frac{18.8g}{188g/mol}$=0.1mol,Br的物质的量与卤代烃的物质的量之比为2:1,所以卤代烃中的Br原子数目为2,
故答案为:2;
(5)已知卤代烃中的Br原子数目为2,其相对分子质量为188,所以分子中烃基的式量为188-80×2=28,烃基的式量除以12,商为碳原子数,余数为氢原子数,所以该烃基为-C2H4,所以卤代烃的分子式为C2H4Br2,所以其结构简式为:CH2BrCH2Br、CH3CHBr2,
故答案为:CH2BrCH2Br、CH3CHBr2.
点评 本题考查有机物的测定,为高频考点,侧重于学生的分析、实验和计算能力的考查,题目难度较大,注意掌握检验卤代烃中卤素原子的检验方法,试题培养了学生灵活应用所学知识的能力.

| A. | 已知常温下0.1mol•L-1NaHA溶液的pH=9,则:c(Na+)═c(A2-)+c(HA-)+c(H2A) | |
| B. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH${\;}_{4}^{+}$)=c(K+)=c(Ba2+) | |
| C. | 25℃,pH=12的氨水和pH=2的盐酸等体积混合:c(Cl-)>c(NH${\;}_{4}^{+}$)>c(H+)>c(OH-) | |
| D. | 向AgNO3溶液中先滴加NaCl溶液至不再有沉淀生成,继续滴加Na2S溶液,观察到白色沉淀转化为黑色,则溶解度大小关系为:Ag2S>AgCl |
| A. | N2、H2、NH3的浓度不再变化 | B. | N2、H2、NH3的浓度为1﹕3﹕2 | ||
| C. | N2、H2、NH3在密闭容器中共存 | D. | 反应停止,正、逆反应速率都等于0 |
| A. | NaCl和HNO3 | B. | H2O和NH3 | C. | CaF2和MgCl2 | D. | CCl4和HCl |
| 微粒 | ClO- | ClO2- | ClO3- | ClO4- |
| 立体结构 | 直线 | V型 | 三角锥形 | 正四面体 |
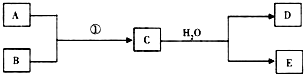 (1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.
(1)若条件①为点燃,目前60%的B都是从海水中提取的,气体D可以使湿润的红色石蕊试纸变蓝,写出C与H2O反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3.上世纪60年代就有人将气体D作为燃料电池的燃料源进行了试验,制成D-空气燃料电池系统,总反应式为:D+O2→A+H2O(未配平),写出此碱性燃料电池的负极反应式:2NH3+6OH--6e-=N2+6H2O.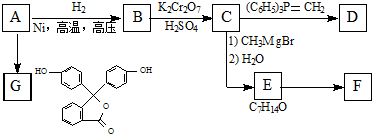
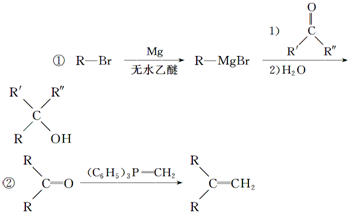 (R表示烃基,R和R表示烃基或氢)
(R表示烃基,R和R表示烃基或氢) .
.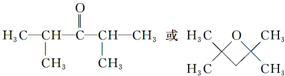 (任写一种).
(任写一种).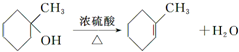 .
.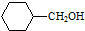 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2+CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:H2C═CH2+CH3CH2Br$→_{△}^{NaOH溶液}$CH3CH2OH.
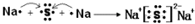 其所含化学键类型为离子键
其所含化学键类型为离子键 ,C与D形成的具有强氧化性的化合物的电子式为
,C与D形成的具有强氧化性的化合物的电子式为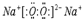

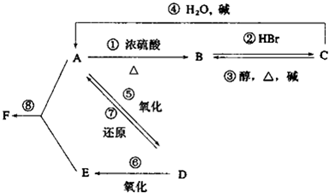 某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A.它们的转化关系如图:
某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A.它们的转化关系如图: