题目内容
19.如图是部分短周期元素的常见化合价与原子序数的关系图: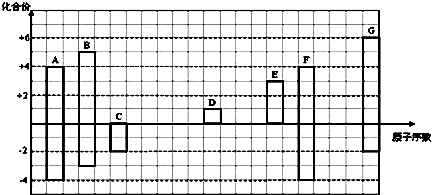
(1)元素A在周期表中的位置第二周期ⅣA族.
(2)用电子式表示D2G的形成过程
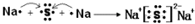 其所含化学键类型为离子键
其所含化学键类型为离子键(3)C2-、D+、G2-离子半径大小顺序是S2->O2->Na+;(用离子符号回答)
(4)C和G的氢化物中,沸点较低的是H2S用化学式回答),原因为水分子间存在氢键.两种气态氢化物的稳定性C>G(填“>”或“<”)
(5)D的最高价氧化物的水化物的电子式为
 ,C与D形成的具有强氧化性的化合物的电子式为
,C与D形成的具有强氧化性的化合物的电子式为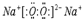
(6)G离子的结构示意图为

(7)D、E的最高价氧化物的水化物发生反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O.
分析 由图中化合价可知,A、F的化合价都为+4、-4价,二者同主族,且F的原子序数较大,故A为碳元素、故F为Si元素;C的化合价为-2价,没有正化合价,故C为O元素;D的化合价为+1价,处于ⅠA族,原子序数大于O元素,故D为Na元素;E为+3价,为Al元素;G的最高正价为+6价、最低价为-2,应为S元素;B的有+5、-3价,处于ⅤA族,原子序数介于C、O之间,则B为N元素,
(1)主族元素周期数=电子层数、主族序数=最外层电子数;
(2)Na2S属于离子化合物,含有离子键,用电子式表示形成过程,左侧为Na、S原子电子式,右侧为氯化钠电子式,中间用“→”连接;
(3)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大;
(4)水分子间存在氢键,所以水的沸点高硫化氢;元素非金属性强氢化物越稳定;
(5)D的最高价氧化物的水化物是氢氧化钠,NaOH的电子式: ,C与D形成的具有强氧化性的化合物是过氧化钠,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为:
,C与D形成的具有强氧化性的化合物是过氧化钠,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: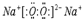 ;
;
(6)硫离子是由硫原子得到了两电子形成的,核内质子数是16,核外电子分三层排布,第一层2个第二层8个第三层8个,所以其离子结构示意图为:
(7)D、E的最高价氧化物的水化物分别是氢氧化钠和氢氧化铝,发生反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O.
解答 解:由图中化合价可知,A、F的化合价都为+4、-4价,二者同主族,且F的原子序数较大,故A为碳元素、故F为Si元素;C的化合价为-2价,没有正化合价,故C为O元素;D的化合价为+1价,处于ⅠA族,原子序数大于O元素,故D为Na元素;E为+3价,为Al元素;G的最高正价为+6价、最低价为-2,应为S元素;B的有+5、-3价,处于ⅤA族,原子序数介于C、O之间,则B为N元素,
(1)A为碳元素,原子有2个电子层,最外层电子数为4,处于周期表中第二周期ⅣA族,故答案为:第二周期ⅣA族;
(2)Na2S属于离子化合物,含有离子键,用电子式表示形成过程为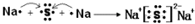 ,
,
故答案为: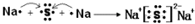 ;离子键;
;离子键;
(3)电子层结构相同核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径S2->O2->Na+,故答案为:S2->O2->Na+;
(4)水分子间存在氢键,所以水的沸点高硫化氢,非金属性O>S,所以水稳定性强于硫化氢,故答案为:H2S;水分子间存在氢键;>;
(5)D的最高价氧化物的水化物是氢氧化钠,NaOH的电子式: ,C与D形成的具有强氧化性的化合物是过氧化钠,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为:
,C与D形成的具有强氧化性的化合物是过氧化钠,过氧化钠是由2个钠离子与1个过氧根离子通过离子键结合而成的离子化合物,电子式为: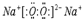 ,故答案为:
,故答案为: ;
;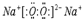 ;
;
(6)S2-的离子结构示意图为: ,故答案为:
,故答案为: ;
;
(7)氢氧化铝和氢氧化钠溶液反应,离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查结构性质位置关系、半径比较、电子式、离子方程式的书写等,难度中等,(7)中离子方程式书写关键是确定氢氧化铝与偏铝酸钠的关系,也可以用方程式进行过量计算解答.


| A. | 乙酸 | B. | 乙醇 | C. | 碳酸钠溶液 | D. | 溴水 |
 如图是一套检验气体的实验装置示意图,向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.根据此现象判断,X和Y可能是( )
如图是一套检验气体的实验装置示意图,向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊:若打开活塞K,则品红溶液褪色.根据此现象判断,X和Y可能是( )| A. | X:SO2,Y:饱和NaHCO3溶液 | B. | X:Cl2,Y:饱和Na2SO3溶液 | ||
| C. | X:HCl,Y:饱和NaHSO3溶液 | D. | X:CO2,Y:饱和Na2CO3溶液 |
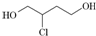 是一种中间产物.下列说法正确的是( )
是一种中间产物.下列说法正确的是( )| A. | 1,3丁二烯分子式为C4H8 | |
| B. | 1,3丁二烯转化为 时,先与Cl2发生1,4加成再水解得到 时,先与Cl2发生1,4加成再水解得到 | |
| C. |  在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应 在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应 | |
| D. |  催化氧化得X,X能发生银镜反应,则X的结构只有两种 催化氧化得X,X能发生银镜反应,则X的结构只有两种 |
| A. | 若容器中X2全部转化为它的同素异形体X3,那么X3的分子量有3种 | |
| B. | 质量数为16的一种核素在此容器中的原子百分数为80% | |
| C. | 只要容器中同位素组成不变,X原子在任何条件下发生重新组合,最后得到三种X2,分子数之比总是15:4:1 | |
| D. | 此容器中X2的平均分子量是32.6 |
 分析图,回答以下问题:
分析图,回答以下问题: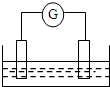 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: