题目内容
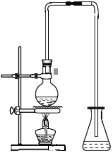
【题目】某化学小组利用以下装置制备氨气、氯气以及LiH固体。

(1)为制备干燥的氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内加入的固体宜选用________;(填选项字母)
a.生石灰 b.氯化钙 c.五氧化二磷
(2)连接装置A、E、E可制取纯净、干燥的氯气,则两个E装置内的药品依次________;装置A中发生反应的离子方程式为________________;
(3)该小组准备利用上述部分装置制备LiH固体.可选用的药品有:金属锂、锌粒、稀盐酸、浓硫酸、碱石灰.已知:氢化锂(LiH)在干燥的空气中能稳定存在,遇水或酸能引起燃烧.设计实验方案如下:
①仪器装置连接顺序为B→D→F→E,加入药品前首先要进行的实验操作是________________(不必写出具体的操作方法);加入药品后,其中装置D的作用是________________。
②加热一段时间后停止加热,继续通氢气冷却,然后取出LiH,装入氮封的瓶里,保存于暗处.采取上述操作的目的是为了避免LiH与空气中的水蒸气接触而发生危险.完成LiH与水反应的化学方程_______;
③准确称量制得的产品0.11g,在一定条件下与足量水反应后,共收集到气体291.2mL(已换算成标准状况),则产品中LiH与Li的物质的量之比为_______________。
【答案】(1)D a (2)饱和食盐水、浓硫酸 2Cl-+MnO2+4H+![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
(3)①检验装置的气密性 除去H2中的H2O和HCl ②LiH+H2O=LiOH+H2↑ ③6:1
【解析】
试题分析:(1)C装置是不需要加热制备氨气的装置,利用浓氨水滴入生石灰产生氨气,浓氨水中存在平衡:NH4++OH-NH3H2O NH3+H2O,加热或者加热碱性物质能够促进平衡正向移动,有利于氨气的挥发,而生石灰与水反应生成氢氧化钙,同时放出大量的热;氢氧化钠溶于水放出大量的热,氢氧化钙、氢氧化钠溶于水电离产生氢氧根离子,促进平衡向正方向移动,有利于氨气的挥发,所以为制备干燥的氨气,可将装置C(分液漏斗中放浓氨水,圆底烧瓶中放生石灰)与D(用碱石灰干燥氨气)连接,制备干燥的氨气;
(2)二氧化锰在加热条件下能够氧化盐酸生成氯化锰、氯气和水,离子方程式为:MnO2+4H++2Cl-
![]() Mn2++Cl2↑+2H2O,生成的氯气中含有氯化氢和水蒸气,由于氯气难溶于饱和食盐水,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;
Mn2++Cl2↑+2H2O,生成的氯气中含有氯化氢和水蒸气,由于氯气难溶于饱和食盐水,通过饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气;
(3)①制备气体装置,加入药品前首先要进行的实验操作是:检验装置气密性;装置D中应选择药品为碱石灰,碱石灰是氧化钙和氢氧化钠的混合物,氧化钙与水可反应,氢氧化钠可作干燥剂,且与盐酸能反应,所以该装置的作用是吸收水蒸气和部分氯化氢气体;
②LiH与水反应生成LiOH、H2,反应方程式为:LiH+H2O=LiOH+H2↑;
③设LiH与Li的物质的量分别为xmol、ymol,则:
LiH+H2O=H2↑+LiOH
xmol xmol
2Li+2H2O=2LiOH+H2↑
ymol 0.5y mol
则8x+7y=0.11,22.4(x+0.5y)=0.2912
解得x=0.012、y=0.002
故LiH与Li的物质的量之比为0.012mol:0.002mol=6:1。