题目内容
【题目】根据题目要求回答下列问题:
(1)某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol/L AgNO3溶液中加入2 mL 0.005 mol/L KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/L Fe(NO3)3溶液 | 溶液变为红色 |
步骤3:向步骤2的溶液中继续加入5滴3 mol/L AgNO3溶液 | 溶液浑浊、红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol/L KI溶液 | 出现黄色沉淀 |
① 步骤3实验目的是_____________________________。
② 用化学平衡原理解释步骤4中的实验现象:___________________________。
(2)已知:
NH4Cl(s) = NH3(g) + HCl(g) ΔH = +163.9 kJmol-1
HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g) ΔH = -31.9 kJmol-1
①写出氯化铵和甲醇反应的热化学方程式____________________________,该反应在一定条件下能自发进行的原因是___________________________。
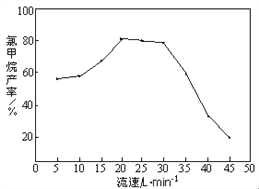
②由下图知,HCl和CH3OH的混合气体通过催化剂时的最佳流速在20 Lmin-1~30 Lmin-1之间。流速过快,会导致氯甲烷产率下降,原因是_________________________。流速过慢,会使副产物二甲醚增多,其反应为2CH3OH → CH3OCH3 + H2O,生产中常通入适量的水蒸气,该操作对制备CH3Cl的影响是___________________________。
(3)某高能锂离子电池充电时,总反应方程式为LiMn2O4=Li1-xMn2O4+xLi。则充电时阳极的电极反应方程式为______________________________________________。若电池的化学能转化为电能时的能量转化率为90%,则当消耗14 g锂时,电路中转移的电子数目为__________NA。
【答案】 证明AgSCN存在溶解沉淀平衡 AgSCN(s) ![]() Ag+(aq)+SCN-(aq),加入KI后,因为溶解度AgI<AgSCN,故Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,AgSCN的溶解平衡正向移动 NH4Cl(s)+CH3OH(g)= NH3(g)+CH3Cl(g)+H2O(g)△H=+132kJmol-1 化学反应自发进行满足条件△G=△H-T△S<0,该反应的△S>0、△H>0,适当提高反应温度△G可能小于0,能自发进行 流速过高反应物与催化剂的接触时间过短,原料利用率降低,导致产率降低 对主副反应有抑制作用,提高CH3Cl纯度的同时,也降低了其产率 LiMn2O4–xe-=Li1-xMn2O4 + xLi+ 1.8
Ag+(aq)+SCN-(aq),加入KI后,因为溶解度AgI<AgSCN,故Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,AgSCN的溶解平衡正向移动 NH4Cl(s)+CH3OH(g)= NH3(g)+CH3Cl(g)+H2O(g)△H=+132kJmol-1 化学反应自发进行满足条件△G=△H-T△S<0,该反应的△S>0、△H>0,适当提高反应温度△G可能小于0,能自发进行 流速过高反应物与催化剂的接触时间过短,原料利用率降低,导致产率降低 对主副反应有抑制作用,提高CH3Cl纯度的同时,也降低了其产率 LiMn2O4–xe-=Li1-xMn2O4 + xLi+ 1.8
【解析】(1)本题考查实验方案设计与评价,①步骤1中两者恰好完全反应,步骤2中滴加1滴Fe(NO3)3,说明溶液中含有SCN-,步骤3中继续滴加5滴AgNO3溶液,溶液变浑浊,证明AgSCN存在溶解沉淀平衡;②AgSCN为白色沉淀,AgI为黄色沉淀,浊液中加入KI溶液,出现黄色沉淀,说明Ksp(AgI)<Ksp(AgSCN),原因是AgSCN(s) ![]() Ag+(aq)+SCN-(aq),加入KI后,因为溶解度AgI<AgSCN,故Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,AgSCN的溶解平衡正向移动;(2)本题考查热化学反应方程式的计算、化学反应方向进行等知识,①NH4Cl(s) = NH3(g) + HCl(g)①,HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g)②,①+②得出:NH4Cl(s)+CH3OH(g)= NH3(g)+CH3Cl(g)+H2O(g)△H=+132kJmol-1,根据反应方程式,△S>0,依据复合判据,△G=△H-T△S,自发进行,△G<0,△H>0,△S>0,自发进行,应在高温下进行;②流速过高反应物与催化剂的接触时间过短,原料利用率降低,导致产率降低;通入适量的水蒸气,对2CH3OH → CH3OCH3 + H2O和NH4Cl(s)+CH3OH(g)= NH3(g)+CH3Cl(g)+H2O(g)都起到抑制,提高CH3Cl纯度的同时,也降低了其产率;(3)本题考查电极反应式的书写和电化学计算,充电时,阳极上失去电子,氧化反应,阳极反应式为LiMn2O4–xe-=Li1-xMn2O4 + xLi+;14gLi被消耗,Li失去电子物质的量为14/7mol=2mol,电池的化学能转化为电能时能量转化率为90%,则整个电路中转移电子物质的量2×90%mol=1.8mol,即个数为1.8NA。
Ag+(aq)+SCN-(aq),加入KI后,因为溶解度AgI<AgSCN,故Ag+与I-反应生成AgI黄色沉淀:Ag++I-=AgI↓,AgSCN的溶解平衡正向移动;(2)本题考查热化学反应方程式的计算、化学反应方向进行等知识,①NH4Cl(s) = NH3(g) + HCl(g)①,HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g)②,①+②得出:NH4Cl(s)+CH3OH(g)= NH3(g)+CH3Cl(g)+H2O(g)△H=+132kJmol-1,根据反应方程式,△S>0,依据复合判据,△G=△H-T△S,自发进行,△G<0,△H>0,△S>0,自发进行,应在高温下进行;②流速过高反应物与催化剂的接触时间过短,原料利用率降低,导致产率降低;通入适量的水蒸气,对2CH3OH → CH3OCH3 + H2O和NH4Cl(s)+CH3OH(g)= NH3(g)+CH3Cl(g)+H2O(g)都起到抑制,提高CH3Cl纯度的同时,也降低了其产率;(3)本题考查电极反应式的书写和电化学计算,充电时,阳极上失去电子,氧化反应,阳极反应式为LiMn2O4–xe-=Li1-xMn2O4 + xLi+;14gLi被消耗,Li失去电子物质的量为14/7mol=2mol,电池的化学能转化为电能时能量转化率为90%,则整个电路中转移电子物质的量2×90%mol=1.8mol,即个数为1.8NA。