题目内容
【题目】石墨和金刚石都是碳元素的单质,已知C(石墨,s)=C(金刚石,s) △H>0,下列说法正确的是
A. 石墨不如金刚石稳定
B. 等质量的石墨与金刚石完全燃烧,二者放出的热量相等
C. 等质量的石墨与金刚石完全燃烧,金刚石放出的能量少
D. 金刚石不如石墨稳定
【答案】D
【解析】
C(石墨,s)=C(金刚石,s)△H>0,为吸热反应,可知石墨能量低,以此来解答。
A.石墨能量低,石墨更稳定,故A错误;
B.等质量的石墨与金刚石完全燃烧,后者放热多,故B错误;
C.等质量的石墨与金刚石完全燃烧,金刚石放出的能量多,故C错误;
D.石墨能量低,金刚石不如石墨稳定,故D正确;
故答案选D。

 阅读快车系列答案
阅读快车系列答案【题目】根据题目要求回答下列问题:
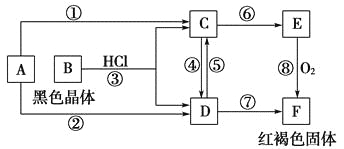
(1)某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol/L AgNO3溶液中加入2 mL 0.005 mol/L KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/L Fe(NO3)3溶液 | 溶液变为红色 |
步骤3:向步骤2的溶液中继续加入5滴3 mol/L AgNO3溶液 | 溶液浑浊、红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol/L KI溶液 | 出现黄色沉淀 |
① 步骤3实验目的是_____________________________。
② 用化学平衡原理解释步骤4中的实验现象:___________________________。
(2)已知:
NH4Cl(s) = NH3(g) + HCl(g) ΔH = +163.9 kJmol-1
HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g) ΔH = -31.9 kJmol-1
①写出氯化铵和甲醇反应的热化学方程式____________________________,该反应在一定条件下能自发进行的原因是___________________________。
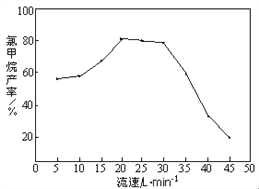
②由下图知,HCl和CH3OH的混合气体通过催化剂时的最佳流速在20 Lmin-1~30 Lmin-1之间。流速过快,会导致氯甲烷产率下降,原因是_________________________。流速过慢,会使副产物二甲醚增多,其反应为2CH3OH → CH3OCH3 + H2O,生产中常通入适量的水蒸气,该操作对制备CH3Cl的影响是___________________________。
(3)某高能锂离子电池充电时,总反应方程式为LiMn2O4=Li1-xMn2O4+xLi。则充电时阳极的电极反应方程式为______________________________________________。若电池的化学能转化为电能时的能量转化率为90%,则当消耗14 g锂时,电路中转移的电子数目为__________NA。
【题目】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4工艺流程如下:
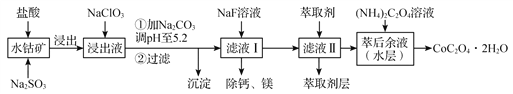
已知:
①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②酸性条件下Co3+的氧化能力很强。
③部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将还原_________(填离子符号)。
(2)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:___________________________________________。
(3)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=______________________。【 已知:Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.00×10-10】
(4)已知:NH3·H2O![]()
![]() +OH Kb=1.8×105;
+OH Kb=1.8×105;
H2C2O4![]() H++
H++![]() Ka1=5.4×102;
Ka1=5.4×102;
![]() H++
H++![]() Ka2=5.4×105。
Ka2=5.4×105。
所用(NH4)2C2O4溶液中离子浓度由大到小的顺序为______________________。
(5)