题目内容
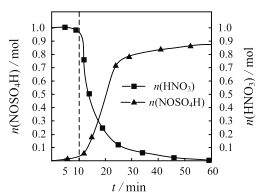
【题目】常温下,向20mL某浓度的硫酸溶液中滴入0.1mol·L-1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图。下列分析不正确的是( )
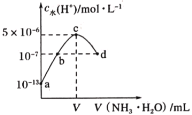
A.V=20
B.b点所示溶液中:c(NH4+)>2c(SO42-)>c(H+)>c(OH-)
C.d点所溶液中:c(NH4+)+c(OH-)=2c(SO42-)+c(H+)
D.NH3·H2O的电离常数K≈2×10-5
【答案】B
【解析】
A. c点水电离出的氢离子浓度最大,则c点溶质为硫酸铵,由于a点水电离出的氢离子浓度为c(H+) = 1×1013molL1,则溶液中氢离子浓度c(H+) =0.1 molL1,氨水和氢离子反应是1:1反应,因此V =20mL,故A正确;
B. b根据电荷守恒c(NH4+)+ c(H+) =2c(SO42)+ c(OH-),溶液显酸性,因此c(H+) > c(OH-),所以c(NH4+)<2c(SO42),故B错误;
C. d点溶质为硫酸铵和氨水的混合溶液,根据电荷守恒c(NH4+)+ c(H+) =2c(SO42)+ c(OH-),由于呈中性,c(H+) = c(OH-),所以c(NH4+)+ c(OH-) =2c(SO42)+ c(H+),故C正确;
D. 在c点溶质为硫酸铵,c(NH4+) = 0.05 molL1,因此NH4+水解常数为![]() ,NH3H2O的电离常数
,NH3H2O的电离常数![]() ,故D正确。
,故D正确。
综上所述,答案为B。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g)![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(X) | n(Y) | n(M) | ||
① | 700 | 0.40 | 0.10 | 0.090 |
② | 800 | 0.10 | 0.40 | 0.080 |
③ | 800 | 0.20 | 0.30 | a |
④ | 900 | 0.10 | 0.15 | b |
下列说法不正确的是( )
A.实验①中,若5min未测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速v(N)=1.0×10-3mol·L-1·min-1
B.实验②中,达到平衡时,Y的转化率为20%
C.实验③中,该反应的平衡常数K=1.0
D.实验④中,达到平衡时, b>0.060