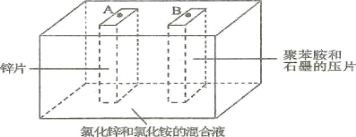
题目内容
【题目】25℃时,向浓度均为0.1mol·L-1、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中![]() 随n(NaOH)的变化如图所示。下列说法正确的是
随n(NaOH)的变化如图所示。下列说法正确的是

A.HX为弱酸,HY为强酸
B.水的电离程度:b>c>d
C.C点对应的溶液中:c(HY)>c(Y-)
D.若将c点与d点的溶液全部混合,溶液中离子浓度大小:c(Na+)>c(X-)>c(Y-)>c(H+)>c(OH-)
【答案】B
【解析】
A、根据图象0.1mol/LHX溶液中lg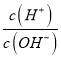 =12,
=12,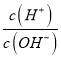 =1×1012,c(H+)c(OH-)=1×10-14,解得c(H+)=0.1mol/L,HX为强酸,0.1mol/LHY溶液中lg
=1×1012,c(H+)c(OH-)=1×10-14,解得c(H+)=0.1mol/L,HX为强酸,0.1mol/LHY溶液中lg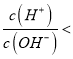 12,HY为弱酸,选项A正确;
12,HY为弱酸,选项A正确;
B、b点时溶液中lg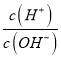 =0,溶液中c(H+ )=c(OH-) ,溶液呈中性;d点、c点加入5×10-3mol的NaOH固体,d点得到等物质的量浓度的NaX和HX的混合液,HX电离出H+使d点溶液呈酸性,c点得到等物质的量浓度的NaY和HY的混合液,c点溶液呈酸性,HY的电离程度大于Y的水解程度,d点溶液中c(H+ )大于c点,d点溶液中H+对水的电离的抑制程度大于c点,水的电离程度: b> c>d,选项B正确;
=0,溶液中c(H+ )=c(OH-) ,溶液呈中性;d点、c点加入5×10-3mol的NaOH固体,d点得到等物质的量浓度的NaX和HX的混合液,HX电离出H+使d点溶液呈酸性,c点得到等物质的量浓度的NaY和HY的混合液,c点溶液呈酸性,HY的电离程度大于Y的水解程度,d点溶液中c(H+ )大于c点,d点溶液中H+对水的电离的抑制程度大于c点,水的电离程度: b> c>d,选项B正确;
C、c点时加入n(NaOH)=0.005mol,此时得到等物质的量浓度的HY和NaY的混合溶液,lg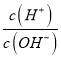 =6,则c(H+)=10-4mol/L,溶液呈酸性,说明HY的电离程度大于NaY的水解程度,故c(HY)<c(Y-),选项C错误;
=6,则c(H+)=10-4mol/L,溶液呈酸性,说明HY的电离程度大于NaY的水解程度,故c(HY)<c(Y-),选项C错误;
D、d点、c点加入5×10-3mol的NaOH固体,d点得到等物质的量浓度的NaX和HX的混合液,c点得到等物质的量浓度的NaY和HY的混合液,溶液呈酸性,电离均大于水解, c(X-)>c(Y-)> c(Na+),选项D错误。
答案选B。

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案