题目内容
【题目】图为一种特殊的热激活电池示意图,当无水LiCl-KCl混合物受热熔融后即可工作。 该电池总反应为: PbSO4(s)+2LiCl+Ca(s) = CaCl2(s)+Li2SO4+Pb(s)。下列说法不正确的是
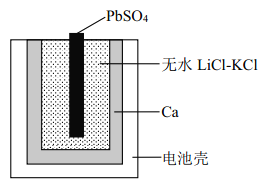
A. PbSO4 电极发生还原反应
B. 负极的电极反应:Ca + 2Cl--2e-=CaCl2
C. 放电时 Li+、 K+向正极移动
D. 用 LiCl 和 KCl 水溶液代替无水 LiCl-KCl,可将该电池改为常温使用的电池
【答案】D
【解析】A. PbSO4 中的Pb得电子发生发生还原反应,故A对;B. 负极活泼金属Ca失电子,其电极反应:Ca + 2Cl--2e-=CaCl2,故B对;C项,放电过程为原电池,阳离子向正极移动,故C项正确;D. 用 LiCl 和 KCl 水溶液代替无水 LiCl-KCl,Ca是活泼金属,会与水反应,故D错;答案:D。

练习册系列答案
相关题目



