题目内容
9.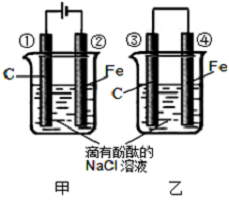 化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.
化学能和电能的相互转化,是能量转化的重要方式之一,如图两个实验装置是实现化学能和电能相互转化的装置.(1)把化学能转化为电能的装置是乙(填“甲”或“乙”);
(2)甲中②的电极名称为阴极
(3)④电极上的电极反应式为Fe-2e-═Fe2+
(4)①电极上的电极反应式为2Cl--2e-═Cl2↑
检验该电极反应产物的方法是把湿润的淀粉KI试纸置于①极附近,若试纸变蓝,则说明有Cl2生成
(5)写出装置甲的反应总化学方程式2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
分析 (1)没有外接电源且能自发进行氧化还原反应的装置为原电池;
(2)甲有外接电源为电解池,与负极相连的②的电极名称为阴极;
(3)乙装置为原电池,铁易失电子作负极,碳作正极;
(4)甲装置为电解池,碳作阳极,阳极上氯离子放电;氯气和碘离子反应生成碘单质,碘遇淀粉试液变蓝色;
(5)甲装置中,阳极上氯离子放电,阴极上氢离子放电.
解答 解:(1)没有外接电源且能自发进行氧化还原反应的装置为原电池,原电池将化学能转化为电能,乙装置能自发进行氧化还原反应,符合原电池条件,所以乙属于原电池,故答案为:乙;
(2)甲有外接电源为电解池,与负极相连的②的电极名称为阴极,故答案为:阴极;
(3)乙装置为原电池,铁易失电子作负极,碳作正极,所以④电极上电极反应式为:Fe-2e-═Fe2+,故答案为:Fe-2e-═Fe2+;
(4)甲装置为电解池,碳作阳极,阳极①上氯离子放电生成氯气,电极反应式为2Cl--2e-═Cl2↑,氯气和碘离子反应生成碘单质,碘遇淀粉试液变蓝色,所以可以用湿润的淀粉碘化钾试纸检验,如果试纸变为蓝色,说明有氯气生成,
故答案为:2Cl--2e-═Cl2↑;把湿润的淀粉KI试纸置于①极附近,若试纸变蓝,则说明有Cl2生成;
(5)甲装置中,阳极上氯离子放电,阴极上氢离子放电生成氢气,所以电池反应式为2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑,故答案为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+Cl2↑+H2↑.
点评 本题考查了原电池和电解池原理,根据是否有外接电源判断原电池和电解池,再结合各个电极上发生的反应来分析解答,知道氯气的检验方法,题目难度不大.

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案| A. | NO3-、K+、Cl-、I- | B. | NH4+、Na+、SO42-、Ba2+ | ||
| C. | Na+、SO42-、HCO3-、K+ | D. | Mg2+、Cl-、SO42-、Na+ |
①氘和氚是质量数不同、质子数相同的氢的两种元素
②氢元素是指1H
③1H、2H、3H是氢的三种同位素,是同一种元素的三种原子
④1H和2H的化学性质几乎完全相同
⑤H2、D2、T2的摩尔质量相等.
| A. | ②③ | B. | ③④ | C. | ①③④⑤ | D. | ②③④⑤ |
 经下列反应后,该物质一定不含有手性碳原子的是( )
经下列反应后,该物质一定不含有手性碳原子的是( )| A. | 酯化 | B. | 水解 | C. | 催化氧化 | D. | 消去 |
| A. | H、D、T表示三种氢原子 | |
| B. | 卤族元素最高化合价均为正7价,最低化合价均为负1价 | |
| C. | 金属元素的原子最外层电子数,都少于4个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
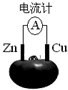
| A. | 铜片为负极,发生还原反应 | B. | 锌片上发生还原反应:Zn-2e-=Zn2+ | ||
| C. | 该装置将电能转变为化学能 | D. | 电子由锌片沿导线流向铜极 |
| A. | 晶胞是晶体中最小的结构基本单元 | |
| B. | 不同的晶体中晶胞的大小和形状都相同 | |
| C. | 晶胞中的任何一个粒子都完全属于该晶胞 | |
| D. | 晶胞都是正方体 |
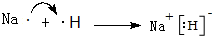 .
.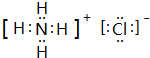 ,A2C2的电子式为
,A2C2的电子式为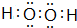 .
.