题目内容
20.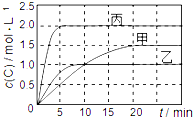 向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:
向甲、乙、丙三个密闭容器中充入一定量的A和B,发生反应:xA(g)+B(g)?2C(g).各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别用下表和如图表示:| 容器 | 甲 | 乙 | 丙 |
| 容积 | 1L | 1L | 2L |
| 温度 | T1 | T2 | T2 |
| 反应物 起始量 | 1molA 2molB | 1molA 2molB | 4molA 8molB |
| A. | 由图可知:T1<T2,且该反应为吸热反应 | |
| B. | T1时该反应的平衡常数K=7.2 | |
| C. | 前10min甲、乙、丙三个容器中A的反应速率:v(A)甲<v(A)乙<v(A)丙 | |
| D. | 平衡时A的质量m:m乙<m甲<m丙 |
分析 A、图象分析可知先拐先平,温度高,反应速率快,温度越高,平衡向吸热反应方向进行;
B、图象得到平衡浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$;
C、前10min,乙和丙温度相同,丙达到平衡时间短,反应速率大,甲和乙在前10minC的浓度增大相同,所以C的反应速率相同;
D、图象可知甲乙起始量相同,达到平衡状态,生成C的浓度不同,甲中为1.5mol/L,乙中为1.0mol/L,则A的质量乙中大;
解答 解:图象分析可知乙,丙相同温度下进行反应,相当于丙比乙的起始量增大一倍,图象中达到平衡状态时,C的浓度并丙中为乙中的2倍,说明容器内是浓度增大一倍,平衡未动,x值为1
A、先拐先平,温度高,比较甲和乙可知,相同条件下乙先达到平衡状态,T2>T1,温度越高,C的浓度越小,说明升温平衡逆向进行,正反应为放热反应,故A错误;
B、T1时的反应结合三段式列式计算平衡浓度
A(g)+B(g)?2C(g)
起始量(mol/L) 1 2 0
变化量(mol/L) 0.75 0.75 1.5
平衡量(mol/L) 0.25 1.25 1.5
K=$\frac{1.{5}^{2}}{0.25×1.25}$=7.2,故B正确;
C、前10min,乙和丙温度相同,丙达到平衡时间短,反应速率大,甲和乙在前10minC的浓度增大相同,所以C的反应速率相同;速率之比等于化学方程式的计量数之比,甲和乙速率相同,乙此时达到平衡,甲为达到平衡,故C错误;
D、图象可知甲乙起始量相同,达到平衡状态,生成C的浓度不同,甲中为1.5mol/L,乙中为1.0mol/L,则A的质量乙中比甲中大,故D错误;
故选B.
点评 本题考查化学反应速率计算、影响化学平衡移动的因素、化学平衡图象与有关计算,难度较大.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 一定条件下从正反应开始的某可逆反应达到化学平衡时,正反应速率降到最小 | |
| C. | 酸与碱发生中和反应时放出的热量叫中和热 | |
| D. | 催化剂不但能改变反应速率,也能改变反应进行的限度 |
| A. | 硝酸钾晶体 | B. | 硫酸钠晶体 | C. | 氯化钡晶体 | D. | 氯化钠晶体 |
| A. | 醋酸可用作调味剂及防腐剂 | B. | CO2和CH4都是温室气体 | ||
| C. | 阿司匹林可用作抗酸药 | D. | 植物油可用于制备人造黄油 |
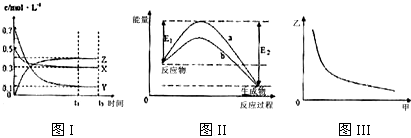
| A. | 该反应热化学方程式为X(g)+3Y(g)?2Z(g)△H=-(E2-E1)kJ•mol-1 | |
| B. | 若图III中甲表示压强,乙表示Z的含量,则其变化符合图III中曲线 | |
| C. | 该温度下,反应的平衡常数数值约为533.若升高温度,该反应的平衡常数减小,Y的转化率降低 | |
| D. | 图II中曲线a是加入催化剂时的能量变化曲线,曲线b是没有加入催化剂时的能量变化曲线 |
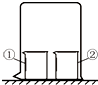 用图所示装置进行下列实验,实验结果与预测现象不一致的是( )
用图所示装置进行下列实验,实验结果与预测现象不一致的是( )| 选项 | ①中物质 | ②中物质 | 预测现象 |
| A | 酚酞溶液 | 浓氨水 | ①中无色变红色 |
| B | CCl4 | 液溴 | ①中变橙色 |
| C | 浓氨水 | 浓硫酸 | 空气中产生白烟 |
| D | NaAlO2溶液 | 浓盐酸 | ①中有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在化学反应进行的过程中放出或吸收的热量称为反应热 | |
| B. | 在稀溶液中,1mol酸跟1mol碱发生中和反应所放出的热量叫做中和热 | |
| C. | 氢氧化钡晶体与氯化铵晶体混合是吸热反应 | |
| D. | 化学反应中的能量变化与参加反应的物质的量成正比 |
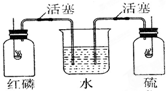 如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )
如图所示,红磷和硫磺在两纯氧集气瓶中燃烧,当火焰熄灭时,观察到的现象是( )| A. | 水迅速进入甲瓶和乙瓶 | B. | 水不进入甲瓶和乙瓶 | ||
| C. | 水只能进入甲瓶而不能进入乙瓶 | D. | 水只能进入乙瓶而不能进入甲瓶 |