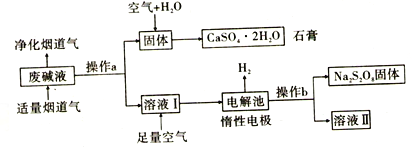
题目内容
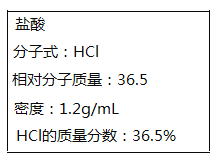
【题目】如图所示为实验室某浓盐酸试剂瓶上标签的有关内容。取该盐酸10mL,加蒸馏水稀释至250mL,向其中加入mg锌粉恰好完全反应。
(1)写出锌粉与盐酸反应的离子方程式______________。
(2)求原浓盐酸的物质的量浓度c=____________。
(3)计算出m=___________。
(4)反应中生成的H2可以和标准状况下______mL的O2恰好完全反应。
(5)向反应后的溶液中加入0.6mol/L的AgNO3溶液至不再产生沉淀,共消耗VmL AgNO3溶液,则V的值是__________。
【答案】Zn+2H+=Zn2++H2↑ 12mol/L 3.9 672 200
【解析】
(1)锌为活泼金属,锌与稀硫酸反应生成硫酸锌和氢气,反应的离子方程式为:Zn+2H+=Zn2++H2↑,故答案为:Zn+2H+=Zn2++H2↑。
(2)根据公式c=1000ρw/M,可得该浓盐酸的物质的量浓度为(1000×1.2×36.5%)/36.5=12mol/L,故答案为:12mol/L;
(3)由稀释定律可知,稀释前后溶质的物质的量不变,则250mL稀释溶液中n(H+)=0.01L×12mol/L=0.12 mol,则n(Zn)=1/2×0.12mol=0.06 mol,m(Zn)= 0.06 mol×65g/mol=3.9g,故答案为:3.9;
(4)250mL稀释溶液中n(H+)=0.01L×12mol/L=0.12 mol,与锌反应生成H2的物质的量为1/2×0.12mol=0.06 mol,由2molH2可以和1molO2完全反应可知,与0.06 mol H2反应的O2的物质的量为1/2×0.06mol=0.03mol,则标准状况下V(O2)0.03mol×22.4L/mol×ml/L=672ml,故答案为:672;
(5)反应后的溶液中n(Cl—)= n(H+),由生成氯化银的反应中消耗Cl—的物质的量等于消耗Ag+物质的量可得:0.6mol/L×V×10—3L=0.12mol,可解得V=200ml,故故答案为:200。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案