题目内容
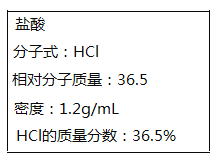
【题目】下列物质①NaHSO4 ②HCl ③Cu ④CO2 ⑤Ba(OH)2 ⑥ NaOH ⑦ NaHCO3 ⑧CH3COOH
(1)属于强电解质的是__________(填序号);水溶液能导电的是_______________(填序号)。
(2)写出下列物质在水溶液中的电离方程式
①:__________________________________________
⑦:__________________________________________
⑧:__________________________________________
(3)写出下列物质相互反应的离子方程式
少量的①与⑤:_______________________________________________。
⑥与⑧:_____________________________________________________。
【答案】①②⑤⑥⑦ ①②④⑤⑥⑦⑧ NaHSO4=Na++H++SO42- NaHCO3=Na++HCO3- CH3COOH![]() CH3COO-+H+ H++OH-+Ba2++ SO42-=H2O+BaSO4↓ CH3COOH+H+=CH3COO-+H2O
CH3COO-+H+ H++OH-+Ba2++ SO42-=H2O+BaSO4↓ CH3COOH+H+=CH3COO-+H2O
【解析】
强电解质是在水溶液中或熔融状态下能完全电离的电解质,包括强酸、强碱、活泼金属氧化物和大部分盐;能导电的物质必须含有自由电子或离子,非金属石墨、金属单质和在熔融状态下的电解质或其溶液能导电,据此解答。
①NaHSO4是强酸的酸式盐,是强电解质,其水溶液能导电;
②HCl是强酸,是强电解质,其水溶液能导电;
③Cu是金属单质,能导电,不是电解质也不是非电解质;
④CO2是非电解质,其水溶液能导电;
⑤Ba(OH)2是强碱,是强电解质,其水溶液能导电;
⑥NaOH是强碱,是强电解质,其水溶液能导电;
⑦NaHCO3是盐,是强电解质,其水溶液能导电;
⑧CH3COOH是弱酸,是弱电解质,其水溶液能导电;
(1)根据以上分析可知属于强电解质的是①②⑤⑥⑦;水溶液能导电的是①②④⑤⑥⑦⑧。
(2)NaHSO4是强酸的酸式盐,是强电解质,其电离方程式为NaHSO4=Na++H++SO42-;NaHCO3是弱酸的酸式盐,是强电解质,其电离方程式为NaHCO3=Na++HCO3-;CH3COOH是弱酸,是弱电解质,其电离方程式为CH3COOH![]() CH3COO-+H+。
CH3COO-+H+。
(3)少量的①与⑤反应生成硫酸钡、氢氧化钠和水,离子方程式为H++OH-+Ba2++SO42-=H2O+BaSO4↓。⑥与⑧反应生成醋酸钠和水,离子方程式为CH3COOH+H+=CH3COO-+H2O。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案