题目内容
【题目】氢化阿托醛  是一种重要的化工原料,其合成路线如下:
是一种重要的化工原料,其合成路线如下:

请根据上述合成路线,回答下列问题:
(1)氢化阿托醛所含官能团的名称为_____________;一定条件下,1 mol氢化阿托醛最多可跟______mol氢气加成。
(2)②的反应类型是__________________。写出它的化学方程式:_____________。
(3)④中所用试剂X为____________。
(4)写出反应⑤的化学方程式:_______________________。
【答案】 醛基 4 消去反应 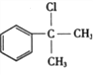 +NaOH
+NaOH![]()
![]() +NaCl+H2O 氢氧化钠溶液 2
+NaCl+H2O 氢氧化钠溶液 2![]() +O2→2
+O2→2![]() +2H2O
+2H2O
【解析】根据题中各物质的转化关系,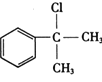 在氢氧化钠醇溶液中发生消去反应生成A为
在氢氧化钠醇溶液中发生消去反应生成A为![]() ,A与溴化氢在双氧水条件下发生信息中的反应生成B为
,A与溴化氢在双氧水条件下发生信息中的反应生成B为![]() ,B在氢氧化钠水溶液中发生水解生成C为
,B在氢氧化钠水溶液中发生水解生成C为![]() ,C发生氧化反应生成氢化阿托醛(
,C发生氧化反应生成氢化阿托醛(![]() )。
)。
(1)根据氢化阿托醛的结构简式可知,所含官能团的名称为醛基,由于氢化阿托醛中有一个苯环和一个醛基,所以一定条件下,1mol氢化阿托醛最多可跟4mol氢气加成,故答案为:醛基;4;
(2)反应②为 在氢氧化钠醇溶液中发生消去反应生成
在氢氧化钠醇溶液中发生消去反应生成![]() ,反应的方程式为
,反应的方程式为 +NaOH
+NaOH![]()
![]() +NaCl+H2O,故答案为:消去反应;
+NaCl+H2O,故答案为:消去反应; +NaOH
+NaOH![]()
![]() +NaCl+H2O;
+NaCl+H2O;
(3)根据上面分析可知,④中所用试剂X为氢氧化钠溶液,故答案为:氢氧化钠溶液;
(4)C为![]() ,C发生氧化反应生成氢化阿托醛(
,C发生氧化反应生成氢化阿托醛(![]() ) ,反应的方程式为:2
) ,反应的方程式为:2![]() +O2→2
+O2→2![]() +2H2O,故答案为:2
+2H2O,故答案为:2![]() +O2→2
+O2→2![]() +2H2O。
+2H2O。

 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案【题目】某化学小组采用下图所示的装置,用环己醇制备环己烯。
已知: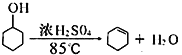
相对分子质量 | 密度/g cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 82 | 0.81 | -103 | 83 | 难溶于水 |
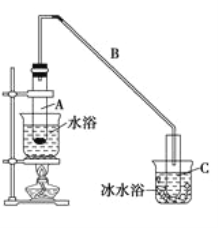
(1)制备粗品
将12.5 mL环己醇与1mL浓硫酸加入试管A中,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①在试管中混合环已醇和浓硫酸操作时,加入药品的先后顺序为______________________。
②如果加热一段时间后发现忘记加碎瓷片,应该采取的正确操作是_________(填字母)。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
③将试管C置于冰水中的目的是_______________________________________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。向粗品中加入饱和食盐水,振荡、静置、分层,环己烯在_______层(填“上”或“下”),分液后用________(填字母)洗涤。
a.酸性KMnO4溶液 b.稀硫酸 c.Na2CO3溶液
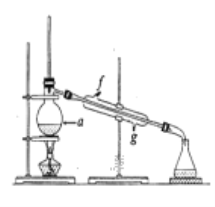
②再将提纯后的环己烯按如图所示装置进行蒸馏。图中仪器a 的名称是_______________,实验中冷却水从______(填字母)口进入。蒸馏时要加入生石灰,目的是__________________________。
(3)若在制备粗品时环已醇随产品一起蒸出,则实验制得的环己烯精品质量_______(填“高于”、“ 低于”)理论产量。本实验所得到的环已烯质量为6.5g,则产率是______(保留一位小数)。
【题目】合成氨的反应为N2+3H2![]() 2NH3+Q。下表是某次反应时NH3的浓度变化:
2NH3+Q。下表是某次反应时NH3的浓度变化:
时间(min) | 0 | 5 | 10 | 15 | 20 |
c(NH3)(mol/L) | 0 | 0.30 | 0.44 | 0.50 | 0.50 |
完成下列填空:
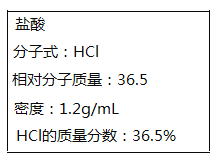
(1)由表中数据计算0~10 min时,用H2表示的平均反应速率为________________。降低温度,反应的平衡常数将______________(填“增大”、“减小”或“不变”)。若要增大反应速率且提高H2利用率,可采取的措施有________________。
(2)若反应中气体混合物的密度保持不变,能否说明该反应已经达到平衡状态?并说明理由。____________________________________________________________________
(3)用右图所示装置进行有关氨气性质的实验,挤出胶头滴管中的水,打开止水夹后的实验现象是_____________。

(4)氨气溶于水后溶液显碱性的原因是(用方程式表示)____________________________________________。若在氨水中逐滴滴加盐酸,则溶液的pH将__________(填“增大”、“减小”或“不变”);当恰好完全反应时,则c(NH4+)________c(Cl-)(填“>”、“<”或“=”)。