题目内容
12.下列有关海水综合利用的说法正确的是( )| A. | 利用电解的方法可以从海水中获取淡水 | |
| B. | 海水蒸发制海盐的过程只发生了化学变化 | |
| C. | 海水中含有钾元素,只需经过物理变化可以得到钾单质 | |
| D. | 从海水中可以得到NaCl,电解熔融NaCl可制备Na |
分析 A.海水中含有大量盐类,电解海水不能获取淡水,淡化海水的方法有蒸馏法、结晶法、淡化膜法等;
B.海水蒸发制海盐的过程是物理变化过程;
C.海水中含有钾离子,要得到K单质需要发生化学反应;
D.从海水中通过物理方法得到NaCl,Na是活泼金属,采用电解熔融氯化钠方法获得Na.
解答 解:A.海水中含有大量盐类,从海水中获取淡水不需要发生化学变化,所以电解海水不能获取淡水,淡化海水的方法有蒸馏法、结晶法、淡化膜法等,常用的为蒸馏法和淡化膜法,故A错误;
B.海水蒸发制海盐时,只是氯化钠状态发生变化,没有新物质生成,所以海水制取食盐的过程是物理变化过程,故B错误;
C.海水中含有钾离子,要得到K单质需要采用电解熔融盐的方法获取,该过程有新物质生成,所以发生化学变化,故C错误;
D.通过物理方法暴晒海水得到NaCl,Na是活泼金属,工业上采用电解熔融NaCl的方法获取Na和Cl2,故D正确;
故选D.
点评 本题考查海水资源综合利用,涉及金属冶炼、海水淡化等知识点,明确基本概念及金属活泼性强弱与金属冶炼方法的关系是解本题关键,题目难度不大.

练习册系列答案
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案
相关题目
15.在共价化合物中元素化合价有正负,其主要原因是( )
| A. | 电子有得失 | B. | 共用电子对有偏移 | ||
| C. | 电子既有得失又有电子对偏移 | D. | 含有多种非金属元素 |
16.在下列给定条件的溶液中一定能大量共存的离子是( )
| A. | 无色溶液:Mg2+、NH4+、Cl?、SO42? | |
| B. | 含有0.1mol/L Fe3+的溶液中:Na+、Mg2+、AlO2? | |
| C. | 室温下,pH=3的溶液中:Na+、K+、SiO32?、NO3? | |
| D. | 室温下KW/c(H+)=10?12mol/L的溶液中:Na+、Fe2+、NO3?、SO42? |
17.下列关于工业生产的说法中正确的是( )
| A. | 硫酸工业中合成SO3通常采用常压,是因为常压比高压更有利于SO3的生成 | |
| B. | 氯碱工业中阳离子交换膜的主要作用是防止氯气和氢气以及氢氧化钠反应 | |
| C. | 工业合成氨通常采用500℃的高温主要是为了提高氮气的转化率 | |
| D. | 电解精炼铜时,纯铜作为阳极,粗铜作为阴极 |
4.如图所示装置最适宜用于观测( )
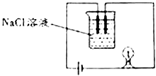

| A. | NaCl溶液的密度 | B. | NaCl溶液的浓度 | ||
| C. | NaCl溶液的酸碱性 | D. | NaCl溶液的导电性 |
1.下列有关实验及操作的叙述中,错误的是( )
| A. | 用水将苯、乙酸、四氯化碳区分开来 | |
| B. | 在实验室中通常将钠保存在汽油里 | |
| C. | 用稀硝酸洗去残留在试管壁上的银 | |
| D. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗涤 |
2.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 对2HI(g)?H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO(正反应放热),升高温度可使平衡向逆反应方向移动 | |
| D. | 打开啤酒瓶盖后产生大量的气泡 |