题目内容
【题目】Ⅰ、对N2(g)+3H2(g)![]() 2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);
2NH3(g) ΔH<0反应,其他条件不变情况下,改变起始氢气物质的量(用n(H2)表示),实验结果如下如图表示(图中T表示温度,n表示物质的量);

(1)比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是______.
(2)若容器容积为1L,n=5mol,T2条件下反应达到平衡时H2的转化率为60%,则且H2与N2物质的量之比为1:1,则在起始时体系中加入N2的物质的量为______mol,反应的平衡常数K=______.
Ⅱ、煤制天然气的工艺流程如图所示:

(3)反应Ⅰ:C(s)+H2O(g) ![]() CO(g)+H2(g) ΔH=+135kJ/mol,
CO(g)+H2(g) ΔH=+135kJ/mol,
①通入的氧气会与部分碳发生燃烧反应。请利用能量转化及配合移动原理说明通入氧气的作用:_______。
②若反应Ⅰ在体积不变的密闭容器中进行,下列能说明反应Ⅰ达到平衡状态的是________。
a.压强不变 b.气体密度不变 c.气体平均摩尔质量不变 d.氢气浓度不变
(4)反应Ⅱ:C0(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH=-41kJ/mol。如图3表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
CO2(g)+H2(g) ΔH=-41kJ/mol。如图3表示不同温度条件下,煤气化反应Ⅰ发生后的汽气比(水蒸气与CO物质的量之比)与CO平衡转化率的变化关系。
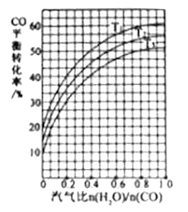
①判断T1、T2和T3的大小关系:________。(从小到大的顺序)
②若煤气化反应Ⅰ发生后的汽气比为0.8,经煤气化反应Ⅰ和水气变换反应Ⅱ后,得到CO与H2的物质的量之比为1:3,则反应Ⅱ应选择的温度是_________(填“T1”或“T2”或“T3”)。
(5)实验室模拟甲烷化反应:一定条件下,向体积为2L的恒容密闭容器中充入1.2molCH4(g)和4.8molCO2(g),发生反应CH4(g)+3CO2(g) ![]() 2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,20s内v(CH4)=______,此反应的ΔH =_____。
2H2O(g)+4CO(g) ΔH>0,实验测得,反应吸收的能量和甲烷的体积分数随时间变化的曲线图像如图。计算该条件下,20s内v(CH4)=______,此反应的ΔH =_____。

【答案】 c 3mol K=0.25 氧气与碳发生燃烧反应放热,放出的热被可逆反应C(s) + H2O(g)![]() CO(g)+H2(g)吸收利用,促进反应正向移动 abcd T1 < T2 < T3 T3 0.009mol(Ls)-1 +330 kJ/mol
CO(g)+H2(g)吸收利用,促进反应正向移动 abcd T1 < T2 < T3 T3 0.009mol(Ls)-1 +330 kJ/mol
【解析】本题考查化学平衡相关知识,包括转化率、平衡标志、平衡移动、速率计算、焓变的计算等。
Ⅰ、(1)起始时氢气的物质的量越多,则越有利于提高氮气的转化率,这说明反应物N2的转化率最高的应该是c点;(2)H2的转化率均为60%,则消耗氢气是3.0mol、剩余2mol,所以根据方程式可知,消耗氮气是1mol、生成的氨气2mol。又因为H2与N2物质的量之比为1:1,所以在起始时体系中加入N2为3mol,剩余氮气为2mol,K=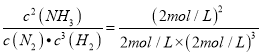 =0.25;
=0.25;
Ⅱ、(3)①反应I:C(s) + H2O(g) ![]() CO(g) + H2(g) ΔH = +135 kJ·mol-1,是吸热反应,而碳与氧气反应放出热量,使反应C(s) + H2O(g)
CO(g) + H2(g) ΔH = +135 kJ·mol-1,是吸热反应,而碳与氧气反应放出热量,使反应C(s) + H2O(g) ![]() CO(g)+H2(g),促进正反应方向移动,提高碳的利用率;
CO(g)+H2(g),促进正反应方向移动,提高碳的利用率;
②若反应Ⅰ在体积不变的密闭容器中进行,反应前后气体物质的量改变,故压强不变可以说明反应Ⅰ达到平衡状态,a项正确;体积不变,正反应气体质量增加,气体密度不变可以说明反应Ⅰ达到平衡状态,b项正确;该反应向正反应方向进行,气体平均摩尔质量减小,故气体平均摩尔质量不变可以说明反应Ⅰ达到平衡状态,c项正确;氢气浓度不变可以说明反应Ⅰ达到平衡状态,d项正确;
(4)①“水气转换”反应是放热的,在相同的“汽气比”前提下,温度越高CO的转化率越低,固有:T1<T2< T3;②反应I的汽气比为0.8,可设水为1mol,则CO为0.8mol,生成的氢气也是0.8mol,设反应II转化的CO为xmol,反应后剩余的CO为(0.8-x)mol,氢气共(0.8+x)mol,即(0.8-x)/(0.8+x)=1/3,x=0.4mol,所以,反应II中CO的转化率为50%,对照图中数据,此时的温度应是T3;
(5) CH4(g) + 3CO2(g) ![]() 2H2O(g) + 4CO(g) ΔH>0
2H2O(g) + 4CO(g) ΔH>0
n(起始/mol) 1.2 4.8 0 0
n (变化/mol) x 3x 2x 4x
n (平衡/mol) 1.2-x 4.8-3x 2x 4x
反应达到平衡后甲烷的体积分数为![]() ,则有
,则有![]() ,x=0.36mol,
,x=0.36mol, ![]() ;CH4反应0.36mol吸收热量为118.8kJ,1mol甲烷完全反应所吸收的热量为
;CH4反应0.36mol吸收热量为118.8kJ,1mol甲烷完全反应所吸收的热量为![]() 330 kJ/mol,故此反应的ΔH=+330 kJ/mol。
330 kJ/mol,故此反应的ΔH=+330 kJ/mol。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】某化学小组研究盐酸被氧化的条件,进行如下实验。
(1)研究盐酸被MnO2氧化。
实验 | 操作 | 现象 |
Ⅰ | 常温下将MnO2和12mol/L浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
Ⅱ | 将Ⅰ中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
Ⅲ | 加热MnO2和4mol/L稀盐酸混合物 | 无明显现象 |
①Ⅰ中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是_________。
②Ⅱ中发生了分解反应,反应的化学方程式是_________。
③Ⅲ中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计试验Ⅳ进行探究(如图1):

将实验Ⅲ、Ⅳ作对比,得出的结论是_______;将实验现象Ⅳ中的i、ii作对比,得出的结论是_______。
④用如图装置(a、b均为石墨电极)进行实验Ⅴ:
ⅰ、K闭合时,指针向左偏转
ⅱ、向右管中滴加浓H2SO4至c(H+)>7mol/L,指针偏转幅度变化不大
ⅲ、再向左管中滴加浓H2SO4至c(H+)>7mol/L,指针向左偏转幅度增大

将实验V中的ⅰ和ⅱ、ⅲ作对比,得出的结论是___________。
(2)研究盐酸能否被氧化性酸氧化。
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象。由此得出浓硫酸___________(填“能”或“不能”)氧化盐酸。
②向试管中加入3mL浓盐酸,在加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2。
通过实验Ⅰ、Ⅱ、Ⅲ证明混合气体中含有Cl2,Ⅲ的操作是_________。
实验 | 操作 | 现象 |
Ⅰ | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
Ⅱ | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
Ⅲ | …… | 试纸先变蓝,不褪色 |
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、__________有关。

