题目内容
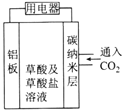
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_________________。(填化学式)
(2)在合成塔中,若有4400g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,该反应的热化学方程式为_________________。
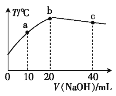
(3)一定条件下,往2 L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是_________________(填“反应I”、“反应II”、“反应III”)。同一种催化剂,温度越高,催化效果_________________(填“不变”、“增强”、“减弱”),分析其原因可能是_________________(填字母)。
A.温度升高,平衡逆向移动 B.温度升高,催化剂失活
C.温度升高,催化剂脱附率增加 D.温度升高,平衡常数减小
②b点v(正)________v(逆)(填“>”、“<”或“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是_________________。
④c点时该反应的平衡常数K=_________________。
【答案】KHCO3 CO2(g)+3H2(g) = H2O(g)+CH3OH(g) ΔH=-53.7 kJ/mol 反应I 减弱 BC > 该反应正反应方向为放热反应,温度升高,平衡逆向移动,转化率降低 5.33 L2mol-2
【解析】
(1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3,KHCO3在分解池中分解生成二氧化碳;
(2)首先算出1mol二氧化碳反应放出的热量,再书写热化学方程式;
(3)①由图象知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率;②T3的b点时,反应未达到限度;③该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,使CO2的转化率降低;④根据三段式计算出平衡时各种物质的浓度,再根据平衡常数表达式计算。
(1)吸收池中盛有饱和碳酸钾溶液,吸收空气中的二氧化碳,转化为KHCO3,KHCO3在分解池中分解生成二氧化碳,因此分解池中主要物质为KHCO3,故答案为:KHCO3;
(2)1mol二氧化碳反应放出热量为5370kJ×![]() =53.7kJ,该反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-53.7kJ/mol,故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-53.7kJ/mol;
=53.7kJ,该反应的热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-53.7kJ/mol,故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H=-53.7kJ/mol;
(3)①由图像知:反应Ⅰ在较低温度T3时CO2就达到80%的转化率,催化剂效果最佳的反应是反应Ⅰ;根据图像,同一种催化剂,温度越高,催化效果减弱,原因可能为:A.催化剂不改变平衡的移动,错误;B.温度升高,催化剂失活,使得催化效果减弱,正确;
C.温度升高,催化剂脱附率增加,使得催化效果减弱,正确;D.催化剂不改变平衡的移动,不能改变平衡常数,错误;故选BC,故答案为:反应Ⅰ;减弱;BC;
②T3的b点时,未达到反应限度,反应继续正向进行,故v(正)>v(逆),故答案为:>;
③该反应为放热反应,T4反应已经达到平衡,升高温度到T5平衡向逆反应移动,从而使CO2的转化率降低。T4的a点转化率比T5的c点高,故答案为:该反应为放热反应,温度升高,平衡逆向移动,转化率降低;
④c点时, CO2(g) + 3H2(g) CH3OH(g) + H2O(g)
起始(mol/L): 0.5 1.5 0 0
转化(mol/L):0.5×![]() 0.5×
0.5×![]() ×3 0.5×
×3 0.5×![]() 0.5×
0.5×![]()
平衡(mol/L): ![]() 0.5
0.5 ![]()
![]()
在温度为T5时,该反应的平衡常数K=![]() =
=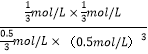 =
=![]() L2mol-2=5.33 L2mol-2,故答案为:
L2mol-2=5.33 L2mol-2,故答案为:![]() L2mol-2(或5.33 L2mol-2)。
L2mol-2(或5.33 L2mol-2)。

【题目】下表为元素周期表的一部分用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:________。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为_______________,第三周期中除⑩元素以外离子半径最小的是_________(填离子符号)。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为______________。在反应后的溶液中加入有机溶剂四氯化碳(CCl4),振荡后静置的实验现象为_______________。
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式________;④⑧⑨元素的离子的还原性由强到弱顺序为____________(用离子符号)。