题目内容
【题目】下表为元素周期表的一部分用元素符号或化学式回答下列问题。
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ⑥ | ① | ⑦ | ④ | ||||
3 | ③ | ⑤ | ⑧ | ⑩ | ||||
4 | ② | ⑨ |
(1)写出⑥与⑧元素组成的分子的电子式:________。
(2)①的气态氢化物与其最高价氧化物水化物反应的方程式为_______________,第三周期中除⑩元素以外离子半径最小的是_________(填离子符号)。
(4)元素⑧的单质与②⑨形成的化合物的溶液反应的离子方程式为______________。在反应后的溶液中加入有机溶剂四氯化碳(CCl4),振荡后静置的实验现象为_______________。
(5)与②同主族,第三周期的元素单质在⑦的单质中燃烧生成的化合物的电子式________;④⑧⑨元素的离子的还原性由强到弱顺序为____________(用离子符号)。
【答案】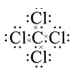 NH3+HNO3=NH4NO3 Al3+ KOH H-O-H 2H2O+2F2=4HF+O2 Cl2+2Br-=Br2+2Cl- 液体分层,上层无色,下层呈橙红色
NH3+HNO3=NH4NO3 Al3+ KOH H-O-H 2H2O+2F2=4HF+O2 Cl2+2Br-=Br2+2Cl- 液体分层,上层无色,下层呈橙红色 ![]() Br->Cl->F-
Br->Cl->F-
【解析】
根据元素在周期表的位置,可确定从①--⑩号元素分别是N、K、Mg、F、Al、C、O、Cl、Br、Ar。然后根据元素周期表与元素周期律的关系分析解答。
(1)⑥与⑧元素组成的分子是CCl4,C原子最外层有4个电子,Cl原子最外层有7个电子,C原子与4个Cl原子形成4个共价键,从而使分子中的每个原子都达到8个电子的稳定结构,所以CCl4的电子式是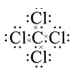 ;
;
(2)①是N元素,其气态氢化物NH3与其最高价氧化物水化物HNO3发生反应生成NH4NO3,反应的方程式为NH3+HNO3=NH4NO3;
在同一周期的元素中,金属元素的原子失去最外层电子,变为上周期惰性气体原子的稳定结构,而非金属原子获得电子变为本周期惰性气体元素的原子的稳定结构;对于电子层结构相同的离子,核电荷数越大,离子半径越小,所以第三周期中除⑩元素以外离子半径最小的是Al3+;
(3)②③⑤三种元素分别是K、Mg、Al,元素的金属性越强,其相应的最高价氧化物电源的水化物的碱性越强,由于元素的金属性K>Mg>Al,所以这三种元素的最高价氧化物对应的水化物的碱性:KOH>Mg(OH)2>Al(OH)3,所以碱性最强的是KOH,元素⑦是O元素,其氢化物是H2O,O原子与2个H原子形成2个共价键,所以水的结构式为H-O-H;该氢化物和元素④单质F2发生反应,产生HF和O2,反应的化学方程式为2H2O+2F2=4HF+O2。
(4)元素⑧的单质是Cl2与②⑨形成的化合物KBr会发生置换反应,产生KCl和Br2,反应的离子方程式为Cl2+2Br-=Br2+2Cl-。在反应后的溶液中加入有机溶剂四氯化碳(CCl4),由于Br2容易溶于四氯化碳,而四氯化碳与水互不相容,密度比水大,所以振荡后静置,观察到的现象是液体分层,上层无色,下层呈橙红色。
(5)与②同主族,第三周期的元素单质是Na,在⑦的单质O2中燃烧生成的化合物是Na2O2,该化合物是离子化合物,其电子式是![]() ;④⑧⑨元素是F、Cl、Br,三种元素在周期表中位于同一主族,由于从上到下原子半径逐渐增大,所以三种元素的离子的还原性逐渐增强,因此三种元素的离子的还原性由强到弱顺序为Br->Cl->F-。
;④⑧⑨元素是F、Cl、Br,三种元素在周期表中位于同一主族,由于从上到下原子半径逐渐增大,所以三种元素的离子的还原性逐渐增强,因此三种元素的离子的还原性由强到弱顺序为Br->Cl->F-。

【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. AB. BC. CD. D






