题目内容
9.下列对分子性质的解释中,不正确的是( )| A. | 已知大多数含氧酸可用通式XOm(OH)n来表示,H2SeO3、HMnO4、H3BO3、H3PO4 四种酸中酸性最强的是H2SeO3 | |
| B. | HF的沸点比H2O低是因水中氢键的键能比氟化氢中氢键能大 | |
| C. | 向加入过量氨水的硫酸铜溶液中加入乙醇,将析出深蓝色晶体来,是因为乙醇分子极性比水小 | |
| D. | H2CO3分子中的非羟基氧的个数为1,然而其酸性较弱,原因是溶于水的二氧化碳分子只有极少数与水结合成碳酸 |
分析 A.含氧酸可用通式XOm(OH)n来表示,式中m大于等于2的是强酸,m为0的是弱酸,据此可知,非羟基氧原子数目越大,酸性越强,将选项中含氧酸改写成XOm(OH)n形式,根据非羟基氧原子数目判断;
B.氢键越多,熔沸点越高;
C.离子化合物易溶于极性溶剂;
D.溶于水的二氧化碳分子只有极少数与水结合成碳酸.
解答 解:A.H2SeO3可以改写为SeO1(OH)2,非羟基氧原子数目为1;HMnO4可以改写为MnO3(OH)1,非羟基氧原子数目为3;H3BO3可以改写为B(OH)3,非羟基氧原子数目为0;H3PO4可以改写为PO1(OH)3,非羟基氧原子数目为1;HMnO4中非羟基氧原子数目最多,酸性最强,故A错误;
B.H2O分子中的O与周围H2O分子中的两个H原子生成两个氢键,而HF分子中的F原子只能形成一个氢键,氢键越多,熔沸点越高,所以H2O熔沸点高,与共价键的键能无关,故B错误;
C.离子化合物易溶于极性溶剂,乙醇分子极性比水小,所以[Cu(NH3)4]SO4•H2O的溶解度在乙醇中比水中要小,故C正确;
D.二氧化碳的溶解度较小,溶于水的二氧化碳分子只有极少数与水结合成碳酸,所以碳酸酸性较弱,故D正确.
故选AB.
点评 本题考查物质的组成、结构和性质的关系,侧重于常识性内容的考查,难度不大,注意基础知识的积累.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.已知 X、Y、Z、Q、R、E六种元素中,原子序数X<Y<Z<Q<R<E,其结构或性质信息如下表.
请根据信息回答有关问题:
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O、N、C.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x 的值为4.
| 元素 | 结构或性质信息 |
| X | 原子的L层上s电子数等于p电子数. |
| Y | 原子核外的L层有3个未成对电子. |
| Z | 在元素周期表的各元素中电负性仅小于氟. |
| Q | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子. |
| R | 核电荷数是Y与Q的核电荷数之和 |
| E | 原子序数比R大3 |
(1)元素Y的原子核外共有7种不同运动状态的电子,有3种不同能级的电子.
(2)X、Y、Z三种元素的电负性由高到低的排列次序依次为(写元素符号)O、N、C.
(3)X、Z、Q元素均表现最低化合价时的三种氢化物中,沸点由高到低的排列次序依次为(写化学式)H2O>HCl>CH4.
(4)R的最高化合价为+6.R的一种配合物的化学式为RCl3•6H2O.已知0.01molRCl3•6H2O在水溶液中用过量硝酸银溶液处理,产生0.02mol AgCl沉淀.此配合物最可能是B.
A.[R(H2O)6]Cl3 B.[R(H2O)5Cl]Cl2•H2O
C.[R(H2O)4Cl2]Cl•2H2O D.[R(H2O)3Cl3]•3H2O
(5)元素E能形成八面体构型的配合物离子[E(YH3)xQ2]+,则中心离子为(写化学式)Co3+,配位体为(写化学式)NH3和Cl-,x 的值为4.
20.下列说法正确的是( )
| A. | SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气 | |
| B. | 由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫 | |
| C. | 稀土元素在自然界中含量非常低,难以开采,但它们在冶金工业中有着重要的用途,被称为冶金工业的维生素 | |
| D. | 金属钠通常被保存在煤油或石蜡油中,以隔绝空气 |
17.为探究NaHCO3、Na2CO3和盐酸(以下盐酸浓度均为1mol•L-1)反应过程中的热效应,实验测得如下数据:
由此得出的结论正确的是( )
| 序号 | 35mL试剂 | 固体 | 混合前 温度/℃ | 混合后 温度/℃ |
| ① | 水 | 2.5g NaHCO3 | 20.0 | 18.5 |
| ② | 水 | 3.2g Na2CO3 | 20.0 | 24.3 |
| ③ | 盐酸 | 2.5g NaHCO3 | 20.0 | 16.2 |
| ④ | 盐酸 | 3.2g Na2CO3 | 20.0 | 25.1 |
| A. | Na2CO3溶液与盐酸的反应是吸热反应 | |
| B. | NaHCO3溶液与盐酸的反应是放热反应 | |
| C. | 20.0℃时,含3.2 g Na2CO3的饱和溶液和35 mL盐酸混合后的温度将低于25.1℃ | |
| D. | 20.0℃时,含2.5 g NaHCO3的饱和溶液和35 mL盐酸混合后的温度将低于16.2℃ |
4.化学学科需要借助化学专用语言描述,下列有关化学用语正确的是( )
| A. | 基态铜原子的价电子排布图: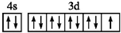 | |
| B. | CO2分子立体结构模型: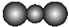 | |
| C. | 三氟化硼的电子式: | |
| D. | 35Br基态原子的电子排布式可简写为[Ar]4s24p5 |
18.如图为元素周期表中短周期主族非金属元素的一部分,下列说法不正确的是( )


| A. | W的原子序数可能是Y的两倍 | |
| B. | Z的原子半径比X的大 | |
| C. | Y元素的非金属性比Z元素的强 | |
| D. | Z的最高价氧化物对应的水化物的酸性比W的强 |