题目内容
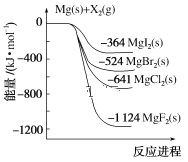
【题目】向Na2CO3溶液中滴加盐酸,反应过程中能量变化如下图所示,下列说法正确的是( )
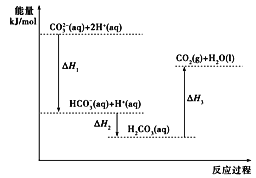
A.反应HCO3- (aq)+H+(aq)=CO2(g)+H2O(l)为放热反应
B.ΔH1>ΔH2 ΔH2<ΔH3
C.CO32- (aq)+2H+(aq)=CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3
D.H2CO3(aq)=CO2(g)+H2O(l) ΔH3<0
【答案】C
【解析】
A. 由图可得,HCO3- (aq)+H+(aq)的能量小于CO2(g)+H2O(l)的能量,所以反应HCO3- (aq)+H+(aq)=CO2(g)+H2O(l)为吸热反应,故A错误;
B. 由图可得ΔH1和ΔH2都小于0,ΔH3>0,且ΔH1的绝对值大于ΔH2的绝对值,所以ΔH1<ΔH2,ΔH2<ΔH3,故B错误;
C. 由图可得,CO32- (aq)+2H+(aq)=HCO3-(aq)+H+(aq) ΔH1,HCO3- (aq)+H+(aq)=H2CO3(aq) ΔH2,H2CO3(aq)=CO2(g)+H2O(l) ΔH3,根据盖斯定律,CO32- (aq)+2H+(aq)=CO2(g)+H2O(l) ΔH=ΔH1+ΔH2+ΔH3,故C正确;
D. H2CO3(aq)=CO2(g)+H2O(l) 为吸热反应,ΔH3>0,故D错误;
故选C。

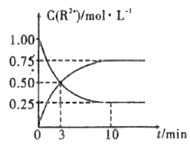
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
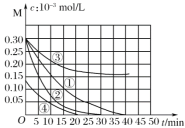
实验编号 | 温度℃ | pH |
① | 25 | 1 |
② | 45 | 1 |
③ | 25 | 7 |
④ | 25 | 1 |
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快