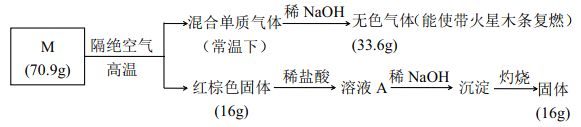
题目内容
【题目】1871年门捷列夫最早预言了类硅元素锗,锗元素在元素周期表中与硅元素同族,并位于硅的下一周期。1886年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。锗是重要的的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。
已知:①丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀:
②GeCl4易水解,在浓盐酸中溶解度低。
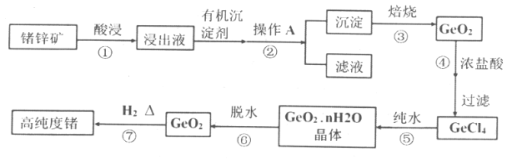
(1)锗元素的原子序数为:___________;锗元素在元素周期表中的位置是:_____________。
(2)GeCl4的结构与SiCl4相似,写出GeCl4的电子式:_______________。
(3)简述步骤①中提高酸浸效率的措施____________、_____________(写两种)。
(4)步骤②操作A是___________(填操作名称)。
(5)步骤③中的物质在___________(填仪器名称)中加热。
(6)步骤④不选用稀盐酸,而选用浓盐酸的原因可能是__________、________(写出两点)。
(7)写出步骤⑤的化学方程式________________。
写出步骤⑦的化学方程式________________。
(8)请写出一种证明步骤⑦反应完全的操作方法__________________。
【答案】32 第四周期第ⅣA族  把矿石粉碎 加热或充分搅拌 过滤 坩埚 防止四价锗水解 防止GeO2不能充分反应,有利于GeCl4析出 GeCl4+(2+n)H2O=GeO2nH2O+4HCl GeO2+2H2
把矿石粉碎 加热或充分搅拌 过滤 坩埚 防止四价锗水解 防止GeO2不能充分反应,有利于GeCl4析出 GeCl4+(2+n)H2O=GeO2nH2O+4HCl GeO2+2H2![]() Ge+2H2O 将反应生成的气体通入装有无水硫酸铜的U形管,无明显现象
Ge+2H2O 将反应生成的气体通入装有无水硫酸铜的U形管,无明显现象
【解析】
锗锌矿用酸浸取,浸出液中含有四价锗和锌离子,加入有机沉淀剂丹宁与四价锗络合形成沉淀,过滤后得到含有丹宁与四价锗络合形成的沉淀,将沉淀焙烧得到GeO2;用浓盐酸溶解GeO2生成GeCl4,GeCl4在浓盐酸中溶解度低,过滤后得到GeCl4;GeCl4在纯水中水解生成GeO2nH2O,GeO2nH2O脱水后得到GeO2,用氢气加热还原GeO2得到高纯度Ge,据此解答。
(1)锗的原子序数为32,锗在元素周期表中位于第四周期第ⅣA族,故答案为:32;第四周期第ⅣA族;
(2)GeCl4的结构与SiCl4相似,也与CCl4相似,属于共价化合物,GeCl4的电子式为 ,故答案为:
,故答案为: ;
;
(3) 提高步骤①酸浸效率,可以把矿石粉碎,加热或充分搅拌都可以加快反应速率,从而提高酸浸效率,故答案为:把矿石粉碎,加热或充分搅拌;
(4)步骤②操作A将沉淀从溶液中分离,应该为过滤,故答案为:过滤;
(5)步骤③是焙烧沉淀,需要在高温下焙烧沉淀得到GeO2,应该在坩埚中进行,故答案为:坩埚;
(6)由于GeCl4易水解,在浓盐酸中溶解度低,所以用浓盐酸溶解GeO2,同时可防止四价锗水解,防止GeO2不能充分反应,有利于GeCl4析出,故答案为:防止四价锗水解,防止GeO2不能充分反应,有利于GeCl4析出;
(7)步骤⑤为GeCl4在纯水中水解生成GeO2nH2O,反应方程式为:GeCl4+(2+n)H2O=GeO2nH2O+4HCl;步骤⑦中用氢气加热还原GeO2得到高纯度Ge,反应方程式为:GeO2+2H2![]() Ge+2H2O,故答案为:GeCl4+(2+n)H2O=GeO2nH2O+4HCl;GeO2+2H2
Ge+2H2O,故答案为:GeCl4+(2+n)H2O=GeO2nH2O+4HCl;GeO2+2H2![]() Ge+2H2O;
Ge+2H2O;
(8)反应GeO2+2H2![]() Ge+2H2O中有水生成,通过验证不再有水产生即可证明反应完全,操作方法为:将反应生成的气体通入装有无水硫酸铜的U形管,无明显现象,说明反应完全,故答案为:将反应生成的气体通入装有无水硫酸铜的U形管,无明显现象。
Ge+2H2O中有水生成,通过验证不再有水产生即可证明反应完全,操作方法为:将反应生成的气体通入装有无水硫酸铜的U形管,无明显现象,说明反应完全,故答案为:将反应生成的气体通入装有无水硫酸铜的U形管,无明显现象。