题目内容
【题目】研究电化学原理与应用有非常重要的意义。
(1)锌锰电池(俗称干电池) 是一种一次电池,生活中应用广泛。
①锌锰电池负极上的电极反应式为:______________________________。
②与普通(酸性)锌锰电池相比较,碱性锌锰电池的优点是____________________(回答一条即可)。
(2)铅蓄电池是最常见的二次电池:Pb+PbO2+2H2SO4 ![]() 2PbSO4+2H2O。
2PbSO4+2H2O。
①充电时阴极反应为:________________________________________。
②用铅蓄电池为电源进行电解饱和食盐水实验(石墨棒为阳极,铁为阴极,食盐水500mL,温度为常温),当电路中有0.05mol电子转移时,食盐水的pH为______(假设溶液体积不变,产物无损耗)。
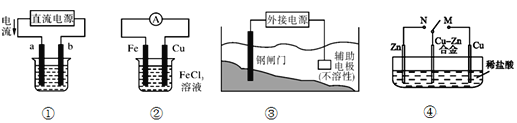
(3)图1是金属(M)-空气电池的工作原理,我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池反应为:___________________________ 。
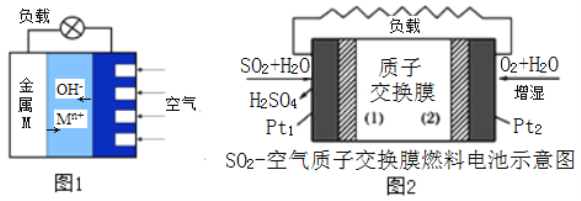
二氧化硫—空气质子交换膜燃料电池实现了制硫酸、发电、环保三位一体的结合,原理如图2所示。Pt2上的电极反应式为:_______________________________________ 。
(4)高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,可以用电解法制取:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图所示。
FeO42+3H2↑,工作原理如图所示。

装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。电解一段时间后,c(OH)降低的区域在_____________(填“阴极室”或“阳极室”);阳极反应为:___________________________。
【答案】Zn-2e-=Zn2+ 比能量高(或可存储时间长、不易发生电解质的泄漏、或碱性电池使用寿命较长其他合理答案也可) PbSO4+2e-=Pb+SO42- 13 4Al+3O2+6H2O=4Al(OH)3 O2+4H++4e-=2H2O 阳极室 Fe+8OH--6e-=FeO42+4H2O
【解析】
(1)①锌锰电池中,锌的活泼性大,做负极;
②碱性锌锰电池比普通锌锰电池性能好,比能量和可储存时间均有提高,据此分析作答;
(2)①充电过程为电解池原理,其阴极得电子,被还原;
②电解饱和食盐水时,阳极氯离子失电子生成氯气,阴极氢离子得电子变为氢气,根据电子转移数与物质之间的关系式计算溶液中氢氧根浓度,进而求出pH;
(3)电池工作时,负极为Al,发生氧化反应,电极反应式为Al-3e-+3OH-=Al(OH)3,正极上通入空气,发生还原反应,正极反应式为O2+2H2O+4e-=4OH-,进而写出总反应式;二氧化硫—空气质子交换膜燃料电池中,Pt2电极上通入的是氧气与水,发生还原反应,电解质为质子交换膜,据此分析作答;
(4)用电解法制备高铁酸钠,电解时阳极区铁失去电子发生氧化反应,结合氢氧根离子生成高铁酸根离子和水,据此分析作答。
(1)①在锌锰干电池中,锌做负极,其电解反应式为:Zn-2e-=Zn2+,
故答案为:Zn-2e-=Zn2+;
②碱性锌锰电池的优点是比能量高、可存储时间长、不易发生电解质的泄漏等,
故答案为:比能量高(或可存储时间长、不易发生电解质的泄漏、或碱性电池使用寿命较长其他合理答案也可);
(2)①电解质溶液为硫酸,根据总反应式可知,在阴极区,硫酸铅得电子转化为铅,其电极反应式为:PbSO4+2e-=Pb+SO42-,
故答案为:PbSO4+2e-=Pb+SO42-;
②电解饱和食盐水发生的总反应为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,2NaOH
2NaOH+H2↑+Cl2↑,2NaOH![]() H2
H2![]() 2e-,则0.05mol电子转移时,n(OH-) = 0.05 mol,故c(OH-) =
2e-,则0.05mol电子转移时,n(OH-) = 0.05 mol,故c(OH-) = ![]() = 0.1 mol/L,pH =-lg
= 0.1 mol/L,pH =-lg ![]() = 13,
= 13,
故答案为:13;
(3)该电池中,负极为Al,正极通入空气,总反应式为:4Al+3O2+6H2O=4Al(OH)3;二氧化硫—空气质子交换膜燃料电池中,Pt2电极为电源的正极,结合质子交换膜可知,发生的电极反应式为:O2+4H++4e-=2H2O,
故答案为:4Al+3O2+6H2O=4Al(OH)3;O2+4H++4e-=2H2O;
(4)用铁做阳极电解氢氧化钠制备高铁酸钠,阳极室铁失去电子,发生氧化反应,结合氢氧根离子生成高铁酸根离子和水,则电解一段时间后,c(OH)降低的区域在阳极室,电极反应式为:Fe+8OH--6e-=FeO42+4H2O;
故答案为:阳极室;Fe+8OH--6e-=FeO42+4H2O;

【题目】下列生产或实验事实引出的相应结论不正确的是( )
选项 | 事实 | 结论 |
A | 工业制硫酸中,在矿石处理阶段,将矿石粉碎再煅烧 | 增大反应物的接触面积,加快化学反应速率 |
B | A、B两支试管中分别加入等体积5%的H2O2,在B试管中加入MnO2,B试管中产生气泡快 | 当其他条件不变时,催化剂可以改变化学反应速率 |
C | 其他条件相同,Na2S2O3溶液和H2SO4溶液反应,升高溶液的温度,析出硫沉淀所需时间变短 | 当其他条件不变时,升高反应温度,化学反应速率加快 |
D | 一定条件下:H2(g)+I2(g) | c(I2)增大,I2物质的量增多 |
A. A B. B C. C D. D