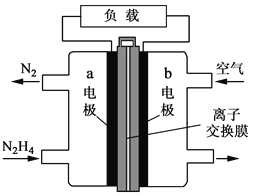
题目内容
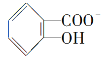
【题目】航天飞机常采用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4、CO、C2H5OH等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷燃料电池以KOH溶液为电解质,其总反应的化学方程式为:CH4+2O2+2OH-=![]() +3H2O。
+3H2O。
(1)负极上的电极反应为________。
(2)正极上的电极反应为________。
(3)消耗标准状况下的5.6 L O2时,有________ mol电子发生转移。
(4)开始放电时,正极附近溶液的pH________(填“增大”、“减小”或“不变”)。
【答案】CH4+10OH--8e-=CO32—+7H2O 2H2O+O2+4e=4OH 1 增大
【解析】
甲烷燃料电池中,甲烷在负极失电子,氧气在正极得电子,结合电解质溶液为KOH溶液分析解题。
(1) 甲烷在负极失电子,则负极上的电极反应为CH4+10OH--8e-=CO32—+7H2O;
(2) 氧气在正极得电子,正极上的电极反应为2H2O+O2+4e=4OH;
(3)消耗标准状况下的5.6 L O2时,转移电子的物质的量为![]() =1mol;
=1mol;
(4)开始放电时,正极上的电极反应为2H2O+O2+4e=4OH,则正极附近溶液的pH增大。

 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
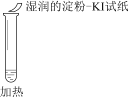
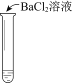
轻松课堂标准练系列答案【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化