��Ŀ����
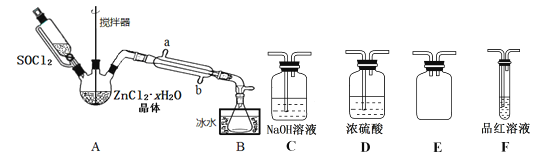
����Ŀ������ʯ����Ҫ�ɷ���K2SO4Al2��SO4��32Al2O36H2O������������Fe2O3 �� ��������ʯ����ȡ������Al2O3��K2FeO4��H2SO4�Ĺ���������ͼ��ʾ�� 
��ش��������⣺
��1������¯�з�����Ӧ�Ļ�ѧ����ʽΪ2Al2��SO4�� ![]() 2Al2O3+6SO2��+3O2����������102gAl2O3 �� ת�Ƶĵ�����ĿΪ ��
2Al2O3+6SO2��+3O2����������102gAl2O3 �� ת�Ƶĵ�����ĿΪ ��
��2�����ɳ���I�����ӷ���ʽΪ �� ����II�Ļ�ѧʽΪ ��
��3����Һ�����������pH���ˣ�ϴ�ӣ��ɵó���I��֤������I��ϴ�Ӹɾ���ʵ������������� ��
��4��д��Cl2������������ΪK2FeO4�Ļ�ѧ����ʽ�� ��
��5������Һ�еõ�K2SO4����ķ����� ��
��6��K2FeO4Ҳ������Ϊ�缫��ͨ�����Ũ��KOH��Һ����ȡ��д����ⷨ��ȡK2FeO4��������Ӧʽ�� ��
���𰸡�
��1��3.612��1024��6NA
��2��AlO2��+H++H2O=Al��OH��3����Fe��OH��3
��3��ȡ���һ��ϴ��Һ�������Թ��У��μ�BaCl2��Һ������ɫ��ɫ�������ɣ�����ϴ�ɾ�
��4��2Fe��OH��3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O
��5�������ᾧ
��6��Fe+8OH����6e��=FeO42��+4H2O
���������⣺��������ʯ����Ҫ�ɷ���K2SO4Al2��SO4��32Al2O36H2O�������������Fe2O3���ʣ��Ʊ�Al2O3��K2FeO4��H2SO4�Ĺ������̣�������ˮ����Ҫ�ɷ���K2SO4Al2��SO4��32Al2O3 �� �����ա�Al2��SO4��3��+6�۽���ΪSO2��+4�ۣ�Al2��SO4��3��������������Ϊ��ԭ��������2Al2��SO4��3+3S ![]() Al2O3+9SO2 �� �����ܽ�Ϊ������������������Һ��Ӧ����ƫ����أ����ӷ���ʽΪAl2O3+2OH��=2AlO2��+H2O�������ܽ����õ���Һ�к���K+��SO42����AlO2����OH���ȣ��������PHֵ��AlO2��ת��ΪAl��OH��3 �� ��������Al2O3 �� ĸҺ��������Ҫ��K+��SO42�� �� ��������ΪK2SO4 �� ����ΪFe2O3 �� ������Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��XΪFe2��SO4��3 �� ����������Fe2��SO4��3+6KOH=2Fe��OH��3��+3K2SO4 �� ͨ��������2Fe��OH��3+3Cl2+10KOH�T2K2FeO4+6KCl+8H2O���Ƶ�K2FeO4 �� ��1��102gAl2O3�����ʵ�����1mol��������1molAl2O3ʱҲ����3mol�Ķ������������������SԪ�صĻ��ϼ�Ϊ+6�ۣ����������е�SԪ�صĻ��ϼ�Ϊ+4�ۣ���������3mol�Ķ�������ת�Ƶ��ӵ����ʵ�����6mol����3.612��1024��6NA �� ���Դ��ǣ�3.612��1024��6NA����2������I��������������������ʯ������ˮ�����ա�������������Һ��Ӧ��õ�����Һ�к���ƫ��������ӣ������������������������������ӷ���ʽΪAlO2��+H++H2O=Al��OH��3��������II������������������Һ��Ӧ���ɸ�����أ����Գ���II�Ļ�ѧʽΪ Fe��OH��3 �� ���Դ��ǣ�AlO2��+H++H2O=Al��OH��3����Fe��OH��3����3������������ƫ�������Һ��������Һ��Ӧ�IJ�������������������п��ܺ�����������ӣ�֤�������Ƿ�ϴ�Ӹɾ���֤��ϴ��Һ���Ƿ�����������ӣ�֤��������ȡ���һ��ϴ��Һ�������Թ��У��μ�BaCl2��Һ������ɫ��ɫ�������ɣ�����ϴ�ɾ���
Al2O3+9SO2 �� �����ܽ�Ϊ������������������Һ��Ӧ����ƫ����أ����ӷ���ʽΪAl2O3+2OH��=2AlO2��+H2O�������ܽ����õ���Һ�к���K+��SO42����AlO2����OH���ȣ��������PHֵ��AlO2��ת��ΪAl��OH��3 �� ��������Al2O3 �� ĸҺ��������Ҫ��K+��SO42�� �� ��������ΪK2SO4 �� ����ΪFe2O3 �� ������Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��XΪFe2��SO4��3 �� ����������Fe2��SO4��3+6KOH=2Fe��OH��3��+3K2SO4 �� ͨ��������2Fe��OH��3+3Cl2+10KOH�T2K2FeO4+6KCl+8H2O���Ƶ�K2FeO4 �� ��1��102gAl2O3�����ʵ�����1mol��������1molAl2O3ʱҲ����3mol�Ķ������������������SԪ�صĻ��ϼ�Ϊ+6�ۣ����������е�SԪ�صĻ��ϼ�Ϊ+4�ۣ���������3mol�Ķ�������ת�Ƶ��ӵ����ʵ�����6mol����3.612��1024��6NA �� ���Դ��ǣ�3.612��1024��6NA����2������I��������������������ʯ������ˮ�����ա�������������Һ��Ӧ��õ�����Һ�к���ƫ��������ӣ������������������������������ӷ���ʽΪAlO2��+H++H2O=Al��OH��3��������II������������������Һ��Ӧ���ɸ�����أ����Գ���II�Ļ�ѧʽΪ Fe��OH��3 �� ���Դ��ǣ�AlO2��+H++H2O=Al��OH��3����Fe��OH��3����3������������ƫ�������Һ��������Һ��Ӧ�IJ�������������������п��ܺ�����������ӣ�֤�������Ƿ�ϴ�Ӹɾ���֤��ϴ��Һ���Ƿ�����������ӣ�֤��������ȡ���һ��ϴ��Һ�������Թ��У��μ�BaCl2��Һ������ɫ��ɫ�������ɣ�����ϴ�ɾ���
���Դ��ǣ�ȡ���һ��ϴ��Һ�������Թ��У��μ�BaCl2��Һ������ɫ��ɫ�������ɣ�����ϴ�ɾ�����4������II������������������Һ��Ӧ���ɸ�����أ���Ԫ�ػ��ϼ����ߣ���Ԫ�صĻ��ϼ۽��ͳ�Ϊ�����ӣ���ѧ����ʽΪ2Fe��OH��3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O��
���Դ��ǣ�2Fe��OH��3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O����5�����������Һ�еõ�����ؾ���ķ����������ᾧ�����Դ��ǣ������ᾧ����6������Ϊ�缫�����Ũ��KOH��Һ����ȡK2FeO4 �� ��������������Ӧ��K2FeO4����Ԫ�صĻ��ϼ�Ϊ+6�ۣ�������ʧ6�����������������ӽ������FeO42�� �� �缫��ӦʽΪFe+8OH����6e��=FeO42��+4H2O��
���Դ��ǣ�Fe+8OH����6e��=FeO42��+4H2O��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�