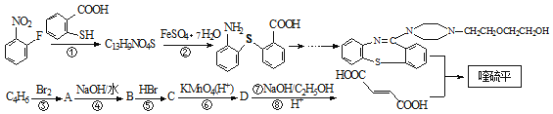
题目内容
【题目】含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如下图所示.下列说法正确的是
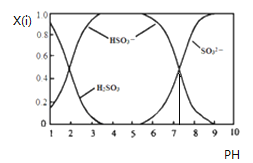
A. pH=8时,溶液中c(HSO3-)>c(SO32-)
B. pH=7时,溶液中c(Na+)=c(HSO3-)+c(SO32-)
C. 为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右
D. 由图中数据可估算出c(H+)×c(SO32-)/c(H2SO3)为10-7.3
【答案】C
【解析】A、当溶液的pH=8时,根据图示得到溶液是亚硫酸钠和亚硫酸氢钠的混合物,离子浓度大小顺序是:c(SO32-)>c(HSO3-),故A错误;B.pH=7时,溶液呈中性,c(H+)=c(OH-),溶液中存在电荷守恒:c(H+)+c(Na+)=c(HSO3-)+2c(SO32-)+c(OH-),故溶液中c(Na+)=c(HSO3-)+2c(SO32-),故B错误;C.根据图象可知,为获得尽可能纯的NaHSO3,可将溶液的pH控制在4~5左右,故C正确;D.由图中数据,pH=2时,c(H2SO3)=c(HSO3-),H2SO3的第一级电离平衡常数Ka1=![]() =c(H+)=10-2,pH=7.3时,c(HSO3- )=c(SO32- ),H2SO3的第二级电离平衡常数Ka2=
=c(H+)=10-2,pH=7.3时,c(HSO3- )=c(SO32- ),H2SO3的第二级电离平衡常数Ka2=![]() =c(H+)=10-7.3,因此c(H+)×c(SO32-)/c(H2SO3)=
=c(H+)=10-7.3,因此c(H+)×c(SO32-)/c(H2SO3)= 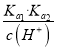 ,与溶液的pH有关,因此比值不是固定值,故D错误;故选C。
,与溶液的pH有关,因此比值不是固定值,故D错误;故选C。

 备战中考寒假系列答案
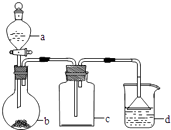
备战中考寒假系列答案【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A.A
B.B
C.C
D.D