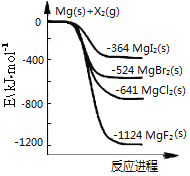
题目内容
【题目】汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致:N2(g)+O2(g)![]() 2NO(g) △H>0。
2NO(g) △H>0。
己知该反应在2404℃时,平衡常数K = 6.4×10-3。请回答下列问题。
(1)该反应的平衡常数表达式为__________。
(2)该温度下,向2L密闭容器中充入N2和O2各lmol,平衡时,N2的转化率是_____%(保留整数)。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L、3.0×10-3mol/L,此时反应______(填“处于化学平衡状态”、“向正方向进行”或“向逆方向进行”),理由是__________。
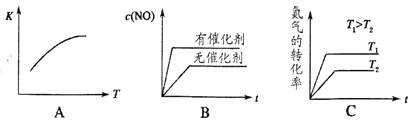
(4)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_____。
(5)向恒温恒容的密闭容器中充入等物质的量的N2和O2, 达到平衡状态后再向其中充入一定量NO, 重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数____(填“变大”、“变小”或“不变”)。
【答案】 K= 4 向正方向进行
4 向正方向进行 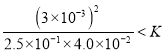 AC 不变
AC 不变
【解析】试题分析:汽车尾气里含有的NO气体是由内燃机燃烧时产生的高温引起氮气和氧气反应所致: N2(g)+O2(g)![]() 2NO(g)ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10-3。
2NO(g)ΔH>0。已知该反应在2404℃时,平衡常数K=6.4×10-3。
请回答下列问题。
(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据方程式可知该反应的平衡常数表达式为K=![]() 。
。
(2)该温度下,向2 L密闭容器中充入N2和O2各1mol,设平衡时消耗氮气和氧气均是xmol,则生成NO设2xmol,所以根据平衡常数可知![]() ,解得x=0.04,则N2的转化率是4%。
,解得x=0.04,则N2的转化率是4%。
(3)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1mol/L、4.0×10-2mol/L和3.0×10-3mol/L,则此时浓度商=![]() <K,所以此时反应向正方向进行。
<K,所以此时反应向正方向进行。
(4)A、正反应吸热,则升高温度平衡向正反应方向进行,平衡常数增大,A正确;B、催化剂不能改变平衡状态,B错误;C、正反应吸热,则升高温度平衡向正反应方向进行,氮气额转化率增大,C正确,答案选AC。向恒温恒容的密闭容器中充入等物质的量的N2和O2,达到平衡状态后再向其中充入一定量NO,由于反应前后体积不变,则相当于增大压强,平衡不移动,因此重新达到化学平衡状态。与原平衡状态相比,此时平衡混合气中NO的体积分数不变。

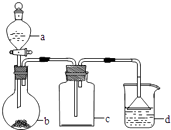
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置).仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
A.A
B.B
C.C
D.D