题目内容
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
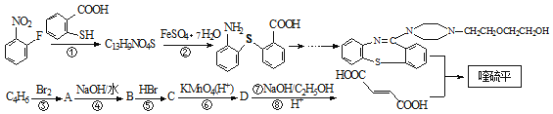
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为_______________。写出SOCl2吸收水蒸气的化学方程式:_______________________________。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):
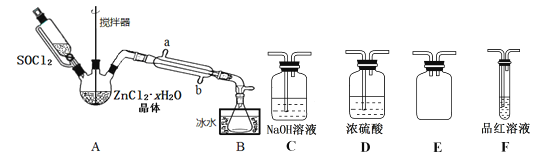
①装置的连接顺序为A→B→____→___→___→____。
②冷凝管的进水口是_______________。(填“a”或“b”)
③实验结束,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤洗涤干燥,称得固体为bg。若b/a=___(保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不行,请解释原因______________________。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。戊同学设计了如下实验方案判断丁同学的观点:
取少量FeCl3 6H2O于试管中,加入SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应。按照戊同学的思路方法,还可以选择证明__________或______________(填离子符号)是否存在证明该过程是否发生了氧化还原反应。
【答案】 2:3 1 SOCl2+H2O=SO2↑+2HCl↑ D E F C b 2.1 会发生水解反应生产ZnO Fe2+、SO42-
【解析】(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,2S+3Cl2 +SO3==3SOCl2,则三者的物质的量比为2:3:1;SOCl2遇水剧烈反应生成SO2与HCl,反应方程式为:SOCl2+H2O=SO2↑+2HCl↑;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气种二氧化硫与HCl,防止污染环境,E装置防止倒吸,装置的连接顺序为A→B→D→F→E→C;
②搅拌可以增大接触面积,加快脱水速率;温度过高SOCl2会分解,应采取水浴加热,受热均匀,便于控制温度;应整个冷凝管充满冷凝水,充分冷却,应从b口进水;
③ZnCl2xH2O完全脱水得到ZnCl2,则ag为ZnCl2的质量,溶于水后加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg为AgCl的质量,由氯离子守恒:2ag/136g/mol= bg/143.5g/mol,b/a=2.1
④ZnCl2加热时会水解为氢氧化锌与HCl,氢氧化锌受热分解为ZnO,不能得到ZnCl2,该方案不可行;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,实验证明脱水时发生了氧化还原反应,只要证明. Fe2+或SO42-的存在。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案