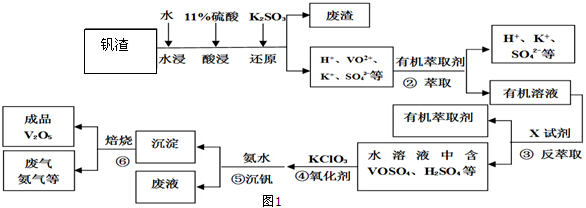
题目内容
17.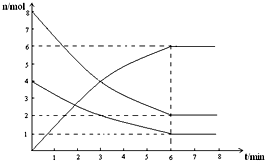 在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示:
在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2.测得各物质的物质的量随时间的变化曲线如图所示:(1)反应到平衡时SO2的转化率为75%.
(2)下列叙述能说明上述反应达到平衡状态的是CDE.(填字母)
A.混合气体中SO2与O2的物质的量之比为2:1且保持不变
B.混合气体的总质量不随时间的变化而变化
C.混合气体的总物质的量不随时间的变化而变化
D.单位时间内每消耗2mol SO2,同时生成1mol O2
E.混合气体的压强不随时间的变化而变化
F.混合气体的密度不随时间的变化而变化.
分析 在673K、容积为2L的容器中发生下述反应,2SO2+O2?2SO3,开始时充入8molSO2和4molO2,达到平衡状态,结合图象分析可知三氧化硫物质的量为6mol,二氧化硫物质的量为2mol,氧气物质的量为1mol,结合化学平衡三段式列式;
2SO2+O2?2SO3
起始量(mol/L) 4 2 0
变化量(mol/L) 3 1.5 3
平衡量(mol/L) 1 0.5 3
(1)平衡时SO2的转化率=$\frac{消耗量}{起始量}$×100%;
(2)当反应达到平衡状态时,正、逆反应速率相等(同种物质),各物质的浓度、含量不再改变,以及由此衍生的一些物理量也不变,以此进行判断.
解答 解:开始时充入8molSO2和4molO2,达到平衡状态,结合图象分析可知三氧化硫物质的量为6mol,二氧化硫物质的量为2mol,氧气物质的量为1mol,
2SO2+O2?2SO3
起始量(mol/L) 4 2 0
变化量(mol/L) 3 1.5 3
平衡量(mol/L) 1 0.5 3
(1)平衡时SO2的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{3mol/L}{4mol/L}$×100%=75%,故答案为:75%;
(2)2SO2+O2?2SO3,反应是气体体积减小的反应,
A.物质的量和起始量有关,混合气体中SO2与O2的物质的量之比为2:1且保持不变,不能说明正逆反应速率相同,不能证明反应达到平衡状态,故A错误;
B.密闭容器中气体质量始终不变,混合气体的总质量不随时间的变化而变化,不能说明反应达到平衡状态,故B错误;
C.反应前后气体物质的量进行,当混合气体的总物质的量不随时间的变化而变化,说明反应达到平衡状态,故C正确;
D.单位时间内每消耗2mol SO2,同时生成1mol O2,说明正逆反应速率相同,反应达到平衡状态,故D正确;
E.反应前后气体物质的量进行,压强之比等于气体物质的量之比,混合气体的压强不随时间的变化而变化,说明反应达到平衡状态,故E正确;
F.混合气体质量不变,体积不变,密度始终不变,混合气体的密度不随时间的变化而变化,不能说明反应达到平衡状态,故F错误;
故答案为:CDE.
点评 本题考查了化学平衡的分析判断和计算应用,平衡标志的理解应用,掌握反应特征和分析方法是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 三聚氰胺的摩尔质量为126 | |
| B. | 用三聚氰胺制造的餐具不可以放进微波炉中加热使用 | |
| C. | 三聚氰胺中C、N两种元素的质量比为3:7 | |
| D. | 三聚氰胺中氮元素的质量分数约为66.7% |
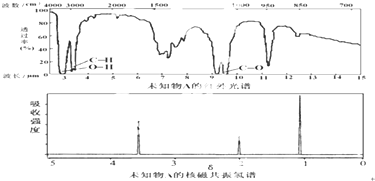
| A. | 由红外光谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 | |
| C. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 | |
| D. | 若A的化学式为C3H6O,则其结构简式为CH3COCH3 |
| A. | Ca(OH)2 | B. |  | C. | NaAlO2 | D. | Na2SiO3 |
| A. | 沼气和液化石油气都是可再生能源 | |
| B. | 煤经气化、液化和干馏三个物理变化过程,可变为清洁能源 | |
| C. | PM 2.5含有的铅、铬、砷等对人体有害的元素均是重金属元素 | |
| D. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白体发生变性 |
| A. | 按系统命名法,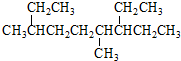 的名称为3,6-二甲基-7-乙基壬烷 的名称为3,6-二甲基-7-乙基壬烷 | |
| B. | 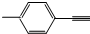 分子中所有原子共平面 分子中所有原子共平面 | |
| C. | 标准状况下,1 L辛烷完全燃烧生成CO28L | |
| D. | 1.0 mol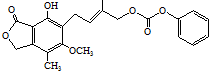 最多能与5.0 mol NaOH水溶液完全反应 最多能与5.0 mol NaOH水溶液完全反应 |
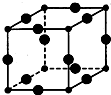 Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用.
Cu3N具有良好的电学和光学性能,在电子工业领域、航空航天领域、国防领域、通讯领域以及光学工业等领域中,发挥着广泛的、不可替代的巨大作用. .
.