题目内容
17.近年来,我国储氢碳管研究获得重大进展,电弧法合成碳纳米管,长伴有大量物质--碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,其反应的化学方程式为:3C+2K2Cr2O7+8H2SO4(稀 )→3CO2↑+2K2SO4+2 Cr2(SO4)3+8 H2O(1)完成并配平上述反应的化学方程式
(2)此反应的氧化剂是K2Cr2O7,还原剂是C
(3)标出反应中电子转移的方向和数目:
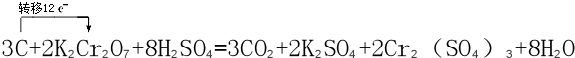
(4)上述反应若产生11g气体物质,则转移电子的数目NA.
分析 (1)反应中C元素的化合价由0升高为+4价,Cr元素的化合价由+6价降低为+3价,结合化合价升降总数相等以及质量守恒定律配平;
(2)氧化剂是指所含元素化合价降低的反应物,得到还原产物;还原剂是指所含元素化合价升高的反应物,得到氧化产物;
(3)反应中C元素的化合价由0升高为+4价,3个C转移电子数为12e-;
(4)结合方程式中转移的电子数来计算.
解答 解:(1)反应中C元素的化合价由0升高为+4价,一个碳化合价变化4,Cr元素的化合价由+6价降低为+3价,1个K2Cr2O7化合价变化6,4和6的最小公倍数为12,由化合价升降总数相等可知,C的化学计量数为3,K2Cr2O7的化学计量数为2,最后由质量守恒定律可知得化学反应为3C+2K2Cr2O7+8H2SO4=3CO2+2K2SO4+2Cr2(SO4)3+8H2O,
故答案为:3;2;8;3;2;2;8;
(2)Cr元素的化合价降低,则K2Cr2O7为氧化剂,C元素的化合价升高,则C是还原剂,故答案为:K2Cr2O7;C;
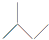
(3)反应中C元素的化合价由0升高为+4价,3个C转移电子数为12e-,电子转移的方向和数目为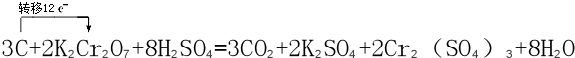 ;
;
故答案为: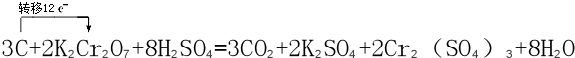 ;
;
(4)由方程式可知:1molC参加反应转移电子为1mol×(4-0)=4mol,产生1molCO2,所以若产生11g气体物质即0.25molCO2,则转移电子的数目为NA,故答案为:NA.
点评 本题考查氧化还原反应方程式的配平,氧化剂、还原剂等概念的了解和判断,以及有关氧化还原反应的简单计算,做题时注意正确判断化合价的变化,在配平时抓住化合价升降总数相等以及质量守恒定律.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
8.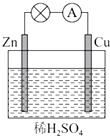 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上描述合理的是( )| A. | Cu为负极,Zn为正极 | B. | Cu极上有气泡产生,发生还原反应 | ||
| C. | SO42-向Cu极移动 | D. | 电子的流向是:Cu-→Zn |
12.25℃在pH=0或pH=14的溶液中,都能大量共存的离子组是( )
| A. | K+,I-,Cl-,SO42- | B. | Fe2+,Na+,Mg2+,Cl- | ||
| C. | SO32-,Na+,K+,NO3- | D. | NH4+,K+,AlO2-,NO3- |
9.已知下列反应的反应热:
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则下列反应的反应热为( )
2C(s)+2H2(g)+O2(g)═CH3COOH(l)
(1)CH3COOH(l)+2O2(g)═2CO2(g)+2H2O(l)△H1=-870.3kJ•mol-1
(2)C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
(3)H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则下列反应的反应热为( )
2C(s)+2H2(g)+O2(g)═CH3COOH(l)
| A. | △H=+488.3 kJ•mol-1 | B. | △H=-244.15 kJ•mol-1 | ||
| C. | △H=-977.6 kJ•mol-1 | D. | △H=-488.3 kJ•mol-1 |
6.实验室中需要配制2mol/L的NaCl溶液250mL,配制时应选用的容量瓶的规格和称取的NaCl质量分别是( )
| A. | 250mL,23.4g | B. | 250mL,29.3g | C. | 500mL,29.3g | D. | 500 mL,58.5g |

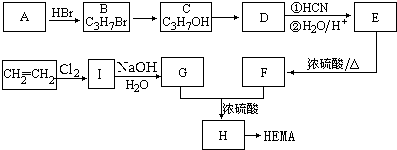
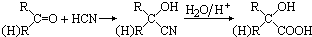
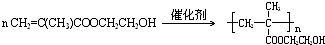 .
. ⑥
⑥