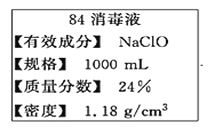
题目内容
【题目】下列化学实验事实及其解释都正确的是
A.过量的铜屑与稀硝酸作用,反应停止后,再加入1 mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1 mol/L稀硫酸反应
B.工业上用电解熔融氯化铝的方法制备金属铝是因为氯化铝的熔点低
C.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜
D.工业制玻璃的主要反应之一:Na2CO3+SiO2![]() Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
Na2SiO3+CO2↑,该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
【答案】C
【解析】
A. 酸性条件下具有很强的氧化性;
B. 工业上冶炼金属铝用电解熔融状态的氧化铝的方法;
C. 浓硝酸具有强氧化性,能使活泼金属钝化;
D. 该反应不是酸与盐反应生成新的酸与新的盐的反应。
A. 过量的铜屑与稀硝酸反应停止后,再加入1 mol/L稀硫酸,溶液中的NO3-在酸性溶液中具有强氧化性,能继续溶解铜,因此铜屑的逐渐溶解并不是因此铜可直接与1 mol/L稀硫酸反应,A项错误;
B. 工业上用电解熔融氧化铝的方法制备金属铝,是因为氯化铝为共价化合物,在熔融状态下不导电,B项错误;
C. 浓硝酸具有强氧化性,能使金属铁钝化,在金属铁的表面形成一层致密的氧化膜,因此用浓硝酸浸泡过的铁钉放入CuSO4溶液中不反应,C项正确;
D. 该反应不是酸与盐反应生成新的酸与新的盐的反应,不符合强酸制弱酸的原理,D项错误;
答案选C。

练习册系列答案
相关题目