题目内容
20.154克NaHCO3和NaCO3的混合物加热到质量不变时剩余物质的质量为123克,求混合物中NaHCO3与Na2CO3的质量.分析 加热发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑,根据固体质量差,利用差量法计算NaHCO3的质量,进而计算碳酸钠的质量.
解答 解:设NaHCO3的物质的量为x,则:
2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑△m
2×84 62
x 154g-123g=31g
所以x=$\frac{2×84×31g}{62}$=84g,
故Na2CO3的质量为154g-84g=70g,
答:混合物中NaHCO3的质量为84g,Na2CO3的质量为70g.
点评 本题考查混合物计算,注意利用差量法计算碳酸氢钠的质量,根据守恒定律理解差量法.

练习册系列答案
相关题目
10.下列有关化学用语表示正确的是( )
| A. | 12753I和12953I2互为同位素 | |
| B. | NH5的电子式为  | |
| C. | 氯原子的结构示意图: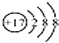 | |
| D. | 中子数为146、质子数为92的铀(U)原子14692U |
11.某气体的质量是同温、同压、同体积氢气质量的23倍,气体的相对分子质量是( )
| A. | 23 | B. | 46 | C. | 69 | D. | 92 |
8.下列有关实验室常用仪器和实验操作正确的是( )
| A. | 实验室用浓硫酸和乙醇制乙烯时,应把温度计的水银球靠近蒸馏烧瓶的支管口处 | |
| B. | 用浓硫酸配置一定物质的量浓度的稀硫酸时,应在量取浓硫酸后,用蒸馏水洗涤量筒并将洗涤液转移到小烧杯中 | |
| C. | 液态溴应贮存在磨口的细口瓶中,加水液封,加盖橡胶塞,并放置于阴凉处 | |
| D. | 应用渗析法提纯胶体时,要不断更换烧杯中的水(或用流动的水)以提高渗析效果 |
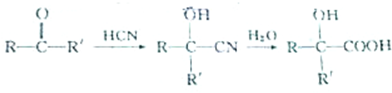 产物分子比原化合物分子多出一个碳原子,增长了碳链.
产物分子比原化合物分子多出一个碳原子,增长了碳链.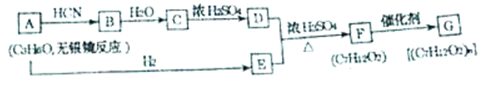
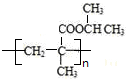 .
.